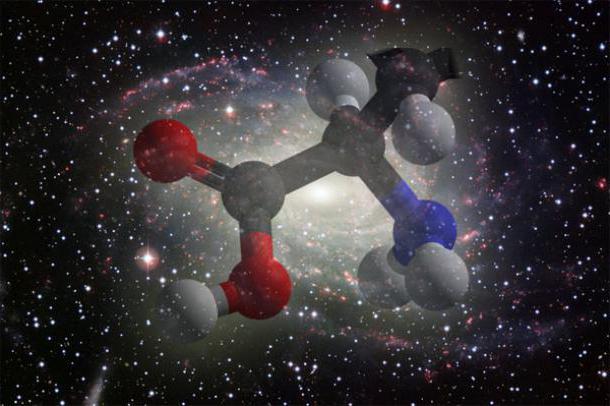
Proteiner är organiska ämnen.Dessa högmolekylära föreningar kännetecknas av en specifik sammansättning och sönderdelas till aminosyror vid hydrolys. Proteinmolekyler kan ha många olika former, många av dem består av flera polypeptidkedjor. Information om ett proteins struktur kodas i DNA, och processen att syntetisera proteinmolekyler kallas translation.
Protein kemisk sammansättning
Det genomsnittliga proteinet innehåller:
- 52% kol;
- 7 % väte;
- 12 % kväve;
- 21 % syre;
- 3 % svavel.
Proteinmolekyler är polymerer. För att förstå deras struktur är det nödvändigt att veta vad deras monomerer - aminosyror - är.
Aminosyror
De är vanligtvis indelade i två kategorier:ständigt förekommande och ibland förekommande. De förra inkluderar 18 proteinmonomerer och ytterligare 2 amider: asparaginsyra och glutaminsyror. Ibland finns det bara tre syror.
Dessa syror kan klassificeras på olika sätt: genom sidokedjornas natur eller laddningen av deras radikaler kan de också delas med antalet CN- och COOH-grupper.
Primär proteinstruktur
Ordningen för alternering av aminosyror i ett proteinkedjan definierar dess efterföljande nivåer av organisation, egenskaper och funktioner. Den huvudsakliga typen av bindning mellan monomerer är peptid. Den bildas genom eliminering av väte från en aminosyra och OH-gruppen från en annan.
Den första nivån av organisation av en proteinmolekyl ärdet är sekvensen av aminosyror i den, bara en kedja som bestämmer strukturen hos proteinmolekyler. Den består av ett "skelett" med en regelbunden struktur. Detta är den upprepade sekvensen –NH-CH-CO-. Individuella sidokedjor representeras av aminosyraradikaler (R), deras egenskaper bestämmer sammansättningen av strukturen hos proteiner.

Även om strukturen hos proteinmolekyler är densamma, så är dekan skilja sig i egenskaper endast från det faktum att deras monomerer har en annan sekvens i kedjan. Ordningen på aminosyror i ett protein bestäms av gener och dikterar vissa biologiska funktioner till proteinet. Sekvensen av monomerer i molekyler som ansvarar för samma funktion är ofta liknande i olika arter. Sådana molekyler - samma eller liknande i organisation och utför samma funktioner i olika typer av organismer - är homologa proteiner. Strukturen, egenskaperna och funktionerna hos framtida molekyler fastställs redan vid syntesen av aminosyrakedjan.
Några vanliga funktioner
Strukturen av proteiner har studerats under lång tid, ochanalysen av deras primära struktur gjorde det möjligt att göra några generaliseringar. Ett stort antal proteiner kännetecknas av närvaron av alla tjugo aminosyrorna, varav glycin, alanin, asparaginsyra, glutamin är särskilt höga och lite tryptofan, arginin, metionin och histidin. De enda undantagen är vissa grupper av proteiner, till exempel histoner. De behövs för DNA-förpackningar och innehåller mycket histidin.
Den andra generaliseringen: i globulära proteiner finns inga generella mönster i växlingen av aminosyror. Men även polypeptider med en avlägsen biologisk aktivitet har små identiska fragment av molekyler.
Sekundär struktur

Den andra nivån av organisation av polypeptidkedjan -detta är dess rumsliga arrangemang, som bibehålls på grund av vätebindningar. α-helixen och β-falden särskiljs. En del av kedjan har inte en ordnad struktur; sådana zoner kallas amorfa.
Alfahelix av alla naturliga proteinerhögerhänt. Laterala aminosyraradikaler i en spiral är alltid vända utåt och är placerade på motsatta sidor om dess axel. Om de är opolära grupperas de på ena sidan av spiralen, bågar erhålls, som skapar förutsättningar för konvergens av olika spiralsektioner.
Beta-veck - mycket långsträckta spiraler - tenderar att vara placerade sida vid sida i en proteinmolekyl och bildar parallella och icke-parallella β-faldiga lager.
Protein tertiär struktur

Den tredje nivån av organisation av en proteinmolekyl ärvikning av spiraler, veck och amorfa områden till en kompakt struktur. Detta beror på växelverkan mellan sidoradikalerna i monomererna med varandra. Sådana anslutningar är indelade i flera typer:
- vätebindningar bildas mellan polära radikaler;
- hydrofob - mellan opolära R-grupper;
- elektrostatiska attraktionskrafter (jonbindningar) - mellan grupper vars laddningar är motsatta;
- disulfidbroar - mellan cysteinradikaler.
Den sista typen av anslutning (-S = S-) ärkovalent interaktion. Disulfidbroar stärker proteiner, deras struktur blir mer hållbar. Men närvaron av sådana anslutningar är inte alls nödvändig. Till exempel kan det finnas mycket lite cystein i polypeptidkedjan, eller dess radikaler finns i närheten och kan inte skapa en "bro".
Fjärde organisationsnivån
Alla proteiner bildar inte en kvartär struktur.Strukturen av proteiner på den fjärde nivån bestäms av antalet polypeptidkedjor (protomerer). De binder till varandra med samma bindningar som den tidigare organisationsnivån, förutom disulfidbryggor. En molekyl består av flera protomerer, som var och en har sin egen speciella (eller identiska) tertiära struktur.

Alla nivåer i organisationen definierar dessa funktionersom kommer att utföra de resulterande proteinerna. Strukturen av proteiner på den första organisationsnivån bestämmer mycket exakt deras efterföljande roll i cellen och kroppen som helhet.
Proteinfunktioner
Det är svårt att ens föreställa sig hur viktig proteinernas roll i cellens aktivitet är. Ovan undersökte vi deras struktur. Funktionerna hos proteiner är direkt beroende av det.
Utför en konstruktion (strukturell) funktion, deutgör grunden för cytoplasman i varje levande cell. Dessa polymerer är huvudmaterialet i alla cellmembran när de är komplexbundna med lipider. Detta inkluderar också uppdelningen av cellen i fack, i vilka deras reaktioner äger rum. Faktum är att varje komplex av cellulära processer kräver sina egna förhållanden, mediets pH spelar en särskilt viktig roll. Proteiner bygger tunna septa som delar upp cellen i så kallade fack. Och själva fenomenet kallades kompartmentalisering.
Den katalytiska funktionen är att reglera alla cellreaktioner. Alla enzymer är av enkla eller komplexa proteiner.
Alla typer av rörelser av organismer (musklers arbete,rörelsen av protoplasman i cellen, blinkande flimmerhår i protozoer, etc.) utförs av proteiner. Strukturen hos proteiner gör att de kan röra sig, bilda fibrer och ringar.

Den hormonella rollen för dessa polymerer är omedelbart tydlig: ett antal hormoner är proteiner i struktur, till exempel insulin, oxytocin.
Reservfunktionen bestäms av det faktum att proteiner kan bilda avlagringar. Till exempel ägg valgumin, mjölkkasein, växtfröproteiner - de lagrar en stor mängd näringsämnen.
Alla senor, artikulära leder, skelettets ben, hovar bildas av proteiner, vilket för oss till deras nästa funktion - att stödja.
Proteinmolekyler är receptorer som utför selektivt erkännande av vissa ämnen. I en sådan roll är glykoproteiner och lektiner speciellt kända.
De viktigaste faktorerna för immunitet - antikroppar och systemetkomplement i ursprung är proteiner. Till exempel är blodkoaguleringsprocessen baserad på förändringar i fibrinogenproteinet. De inre väggarna i matstrupen och magsäcken är fodrade med ett skyddande lager av slemproteiner - lyciner. Toxiner är också proteiner i ursprung. Grunden för huden som skyddar djurkroppen är kollagen. Alla dessa funktioner hos proteiner är skyddande.

Tja, den sista funktionen är reglerande. Det finns proteiner som styr hur genomet fungerar. Det vill säga de reglerar transkription och översättning.
Oavsett vilken viktig roll proteiner spelar, har strukturen av proteiner klarats upp av forskare under lång tid. Och nu upptäcker de nya sätt att använda denna kunskap.