Mye innen kvantemekanikk forblir utenfor grenseneforståelse, mye virker fantastisk. Det samme gjelder kvantetall, hvis art fremdeles er mystisk i dag. Artikkelen beskriver konseptet, typene og generelle prinsippene for å jobbe med dem.
Generelle egenskaper

Heltal eller halvtall kvantetall for fysiskemengder bestemmer alle slags diskrete verdier som kjennetegner systemer for kvanta (molekyl, atom, kjernen) og elementære partikler. Bruken av dem er nært knyttet til eksistensen av Planck-konstanten. Diskretiteten til prosesser som forekommer i mikrokosmos reflekterer kvantetall og deres fysiske betydning. De ble først introdusert for å beskrive mønstrene i spektrene til atomet. Men den fysiske betydningen og diskretiteten til individuelle mengder ble bare avslørt i kvantemekanikken.
Et sett som definerer en uttømmende tilstanddette systemet kalles komplett. Alle stater som er ansvarlige for mulige verdier fra et slikt sett danner et komplett tilstandssystem. Kvantetall i kjemi med elektronets frihetsgrader bestemmer det i tre romlige koordinater og den indre frihetsgraden - spinnet.
Konfigurasjoner av elektroner i atomer
Et atom inneholder en kjerne og elektroner, mellomsom kreftene av elektrostatisk art virker på. Energien vil øke etter hvert som avstanden mellom kjernen og elektronet avtar. Det antas at den potensielle energien vil være null hvis den fjernes trinnløst fra kjernen. Denne tilstanden brukes som et referansepunkt. Dermed bestemmes elektronens relative energi.
Elektronskallet er et sett med energinivåer. Å tilhøre en av dem kommer til uttrykk ved det viktigste kvantetallet n.

Hovednummer
Det refererer til et spesifikt energinivå medet sett med orbitaler, som har lignende verdier, som består av naturlige tall: n = 1, 2, 3, 4, 5 ... Når et elektron går fra et nivå til et annet, endres det viktigste kvantetallet. Det må huskes at ikke alle nivåer er fylt med elektroner. Når du fyller skallet til et atom, implementeres prinsippet om minst mulig energi. I dette tilfellet kalles staten hans uopphisset eller grunnleggende.
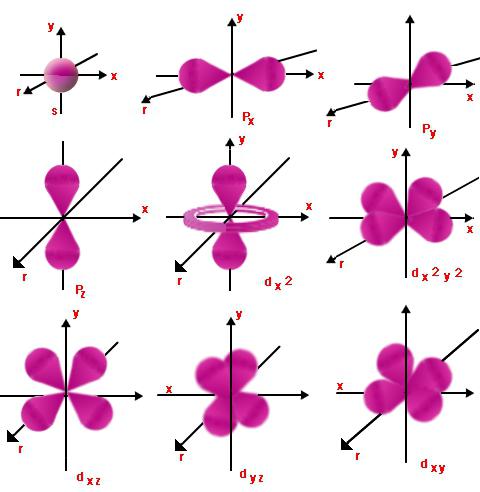
Orbital tall
Hvert nivå har orbitaler.De av dem med lignende energi danner en underplan. En slik oppgave gjøres ved å bruke orbitale (eller som det også kalles siden) kvantetall l, som tar på seg verdiene til heltall fra null til n - 1. Så et elektron som har hoved- og orbital kvantetall n og l kan være like, starter l = 0 og slutter med l = n - 1.
Dette viser arten av de respektive bevegelseneundernivå og energinivå. For l = 0 og en hvilken som helst verdi av n, vil elektronskyen ha form av en kule. Radien vil være direkte proporsjonal med n. Ved l = 1 vil elektronskyen ha form av uendelig eller figur åtte. Jo større verdi på l, jo mer kompleks vil formen bli, og energien til elektronet vil øke.
Magnetiske tall
Ml er projeksjonen av orbitalen (siden)vinkelmoment til en eller annen retning av magnetfeltet. Den viser den romlige orienteringen til de orbitalene som tallet l er det samme for. Ml kan ha forskjellige verdier 2l + 1, fra -l til + l.
Et annet magnetisk kvantetall heterspin - ms, som er det rette øyeblikket for antall bevegelser. For å forstå dette kan man forestille seg rotasjonen av elektronet, som det var, rundt sin egen akse. Ms kan være -1/2, +1/2, 1.
Generelt, for hvilket som helst elektron er spinnets absolutte verdi s = 1/2, og ms betyr dets projeksjon på aksen.
Paulis prinsipp: et atom kan ikke inneholde to elektroner med 4 like kvantetall. Minst en av dem skal være stor.
Regelen om å utarbeide formlene til atomer.
- Prinsippet om minimumsenergi. På den fylles først nivåene og delnivåene, som ligger nærmere kjernen, i henhold til Klechkovskys regler.
- Elementets plassering indikerer hvordan elektronene er fordelt over energinivåer og delnivåer:
- antallet faller sammen med ladningen til atomet og antallet av elektroner;
- det periodiske tallet tilsvarer antall energinivåer;
- gruppetallet sammenfaller med antall valenselektroner i atomet;
- undergruppen viser fordelingen.

Elementære partikler og kjerner
Kvantetall i partikkelfysikker deres interne egenskaper som bestemmer interaksjoner og transformasjonsmønstre. I tillegg til sentrifugeringene er dette den elektriske ladningen Q, som for alle elementære partikler er null eller et helt tall, negativ eller positiv; baryonladning B (i en partikkel - null eller en, i en antipartikkel - null eller minus en); leptonladninger, der Le og Lm er lik null, en, og i antipartikkelen - null og minus en; isotopisk spinn med et helt eller halvtall; fremmedhet S og andre. Alle disse kvantetallene gjelder både elementære partikler og atomkjerner.
I den bredeste forstand av ordet kalles de fysiskemengder som bestemmer bevegelsen til en partikkel eller et system og som er bevart. Imidlertid er det slett ikke nødvendig at de tilhører et diskret spekter av alle mulige verdier.









