Periodinėje Mendelejevo lentelėje 1 numeriuįsikūręs labiausiai paplitęs Visatos elementas - vandenilis. Jo pasiskirstymas procentais yra artimas 75%. Mažiausias jo kiekis pastebimas atmosferos sluoksniuose - 0,0001%. Žemės plutoje yra 1% masės dujų. Didžiausias jo kiekis yra vandenyje: 12%. Tai yra trečias plačiausiai paplitęs cheminis elementas mūsų planetoje.
Prekės aprašymas
Vandenilio molekulė, kurios formulė yra H-H arba H2, pasižymi fizinėmis ir cheminėmis savybėmis.

Vandenilis yra dujos, kurios nėra apdovanotosspalva, jokio kvapo. Vandenilio vieta lentelėje pirmoje vietoje yra dėl to, kad įvairiomis sąlygomis šis elementas gali pasireikšti kaip metalas arba kaip dujos. Išorinėje orbitoje yra 1 elektronas, kurį vandenilis gali suteikti (metalinės savybės) arba paimti kitą (dujų kokybė).
Vandenilio molekulės skersmuo yra 27 nm.
Vandenilio atomo skersmuo yra 1A, spindulys - 0,41 A.
Savybės
Fizinis apima:
- Virimo temperatūra - 256oC.
- Lydymosi temperatūra -259,2oC.
- Oro masė (D) - 0,069.
- Vandenilis blogai tirpsta vandenyje.
Cheminės savybės yra šios:
- Nepolinis ryšys tarp molekulės dalelių turi 436 kJ / mol energiją.
- Terminės disociacijos temperatūra yra 2000 ° CoC.
- Reaguoja su:
- halogenai;
- deguonis;
- pilka;
- azotas;
- azoto oksidas;
- aktyvūs metalai.
Natūraliomis sąlygomis vandenilis randamas tiek natūraliai, tiek izotopų pavidalu: protium, deuterium ir tritium.
Molekulinė struktūra
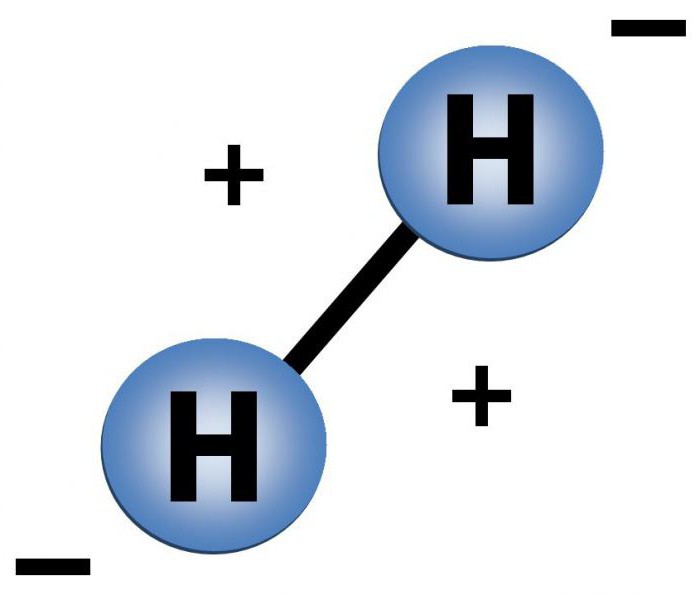
Elemento molekulė turi paprastą struktūrą.Vandenilio molekulės sudėtį vaizduoja du atomai, kurie, artėdami, sudaro kovalentinį nepolinį ryšį, taip pat vieną elektronų porą. Vieno atomo struktūra yra: 1 teigiamai įkrautas branduolys, aplink kurį juda 1 neigiamai įkrautas elektronas. Šis elektronas yra 1s orbitoje.
H - 1e = H + šis vandenilio jonas yra teigiamas.
Ši išraiška rodo, kad vandenilisturi panašius parametrus kaip periodinės sistemos 1 grupės elementai, tai yra šarminiai metalai (ličio, natrio, kalio), dovanojantys savo vienintelį elektroną išorinėje orbitoje.
Н + 1е = Н– neigiamas vandenilio jonas.
Ši lygtis rodo, kad vandenilis yrasusiję su panašiais 7-osios grupės elementais, kurie yra dujos ir sugeba priimti trūkstamus elektronus iki išorinio jų elektroninio lygio. Šios dujos yra: fluoras, chloras, bromas ir kt.
Žemiau grafiškai pavaizduota vandenilio molekulės sudėtis.

Atstumas tarp vandenilio atomų r = 0,74 A, co orbitos spindulių suma yra 1,06 A. Tai daro įtaką elektronų debesų persidengimo gyliui ir stipriam, stabiliam vandenilio ryšiui.
Vandenilio atomas yra elementariausias atomas gamtoje. Atomo protono dydis yra 10,5 A, o vieno atomo skersmuo yra 0,1 nm.
Izotopų molekulės turi ypatingą struktūrą. Protiumo atominį branduolį sudaro tik vienas protonas. Izotopas žymimas: 1H.
Branduolio struktūra atrodo kaip protono ir neutrono (2H) kompleksas.
3H - tritis - savo atominėje struktūroje yra aprūpintas branduoliu su 1 protonu ir dviem neutronais.
Svoris
Moksle yra formulių, kurios apskaičiuoja vandenilio molekulės masę. Elemento atžvilgiu nustatomas molekulinis ir atominis svoris.

Vandenilio molekulės molinė masė apskaičiuojama pagal bendrą formulę:
M = m / n, kur m yra medžiagos masė, n yra jos kiekis.
Atomo masė yra 1,008 amu.Todėl santykinė molekulės masė taip pat bus lygi 1,008. Kadangi vandenilio molekulę sudaro du atomai, santykinė atomo masė yra 2,016 amu. pvz., vandenilio molekulės masė yra išreikšta gramais moliui (g / mol).
Vertė gamtoje

Reikšmingiausia gamtoje esanti medžiaga, sudaranti vandenilį komplekse su deguonimi, yra vanduo. Vanduo yra gyvybės šaltinis, todėl vandenilis yra gyvybiškai svarbus elementas.
100% visų cheminių elementųorganizmo aplinka sudaro 1/10 dalį arba 10% vandenilio. Be vandens, jis sugeba palaikyti ketvirtinę baltymų struktūrą, o tai įmanoma dėl vandenilio jungimosi.
Nukleorūgščių papildomumo principastaip pat įvyksta veikiant vandenilio molekulei. Augalo ląstelėje H dalyvauja fotosintezės, biosintezės ir energijos perdavimo membraniniais kanalais procese.
Paraiška
Vandenilis plačiai naudojamas chemijos pramonėje. Jo dedama gaminant plastikinius gaminius, gaminant muilą, taip pat gaminant amoniaką ir mentolį.
Maisto pramone:maisto gamyboje vandenilis pridedamas kaip maisto priedas E949. Tokį komponentą galima pamatyti ant margarino, augalinių aliejų pakuočių. E949 priedą patvirtino Rusijos Federacijos maisto pramonė.
Kadaise buvo naudojamas vandenilisaeronautikos pramonėje, nes medžiaga yra lengvesnė už orą. Taigi praėjusio amžiaus 30-aisiais balionai ir dirižabliai buvo pripildyti šios rūšies dujų. Nepaisant nedidelės kainos ir paprasto naudojimo, vandenilis netrukus nebebuvo naudojamas kaip užpildas, nes orlaivių sprogimai dažnėjo.
Dujos šiandien naudojamos kaip kurasnaudojama kosmoso pramonėje. Tačiau svarstomi būdai, kaip jį naudoti lengvųjų ir sunkvežimių varikliams eksploatuoti, nes degimo metu elementas neišskiria kenksmingų priemaišų į atmosferą, todėl yra ekologiškas.
Neatsiejamas vandenilio izotopų komponentasveikia kaip daugelio vaistų dalis. Deuteris naudojamas farmakologiniuose tyrimuose, siekiant nustatyti vaisto elgesį ir poveikį organizme. Tritis naudojamas radiodiagnostikoje kaip elementas, lemiantis fermentų metabolizmo biochemines reakcijas. Vandenilis yra dezinfekuojančio peroksido dalis.






