メタンとその同族体は制限と呼ばれます(飽和)パラフィン系炭化水素またはアルカン。有機物質のラストネーム(一般的な化学式CnH2n + 2は、分子の飽和を反映し、原子は単純な共有結合で結合されています。炭素-水素または炭素-炭素)は、化学の国際的な命名法に従って割り当てられました。化合物。それらには、原油と天然ガスの2つの主要な供給源があります。同族列のアルカンの特性は、分子内の炭素原子の数が増えると定期的に変化します。
同族列の最初の4つの代表歴史的な名前があります。その背後にある炭化水素は、末尾が–anのギリシャ数字で示されます。後続の各炭化水素の相対分子量は、前の炭化水素と14amu異なります。融点(凝固)および沸騰(凝縮)点、密度、屈折率などのアルカンの物理的特性は、分子量の増加とともに増加します。メタンからブタンは気体であり、ペンタンからペンタデカンは液体であり、次に固体が続きます。すべてのパラフィンは水よりも軽く、水に溶けません。アルカンには以下が含まれます:
- CH4-メタン;
- C2H6エタン;
- C3H8-プロパン;
- C4H10-ブタン;
- C5H12-ペンタン;
- C6H14ヘキサン;
- C7H16ヘプタン;
- C8H18-オクタン;
- C9H20-ノナン;
- C10H22-デカン;
- C11H24-ウンデカン;
- C12H26-ドデカン;
- C13H28-トリデカン;
- C14H30-テトラデカン;
- C15H32-ペンタデカン;
- C16H34-ヘキサデカン;
- C17H36-ヘプタデカン;
- C18H38-オクタデカン;
- C19H40-ノナデカン;
- C20H42-エイコサンなど。
アルカンの化学的性質は低いアクティビティ。これは、非極性のC-C結合と低極性のC-H結合の相対的な強度、および分子の飽和によって説明されます。すべての原子は単一のσ結合で接続されていますが、分極率が低いため破壊が困難です。それらの破裂は、ラジカルが形成されている間、特定の条件下でのみ発生する可能性があり、ラジカルは、末尾が置き換えられた対応するパラフィン化合物の名前を持っています。たとえば、プロパン-プロピル(C3H7–)、エタン-エチル(C2H5–)、メタン-メチル(CH3–)などです。
アルカンの化学的性質は不活性を示しますこれらの化合物。それらは愛着反応ができません。置換反応はそれらに典型的です。パラフィン系炭化水素の酸化(燃焼)は、高温でのみ発生します。それらはアルコール、アルデヒドおよび酸に酸化される可能性があります。 450〜550°Cの温度での高級アルカンの分解(炭化水素の熱分解プロセス)の結果として、より低い分子量の飽和炭化水素が形成される可能性があります。温度が上昇すると、熱分解は熱分解と呼ばれます。
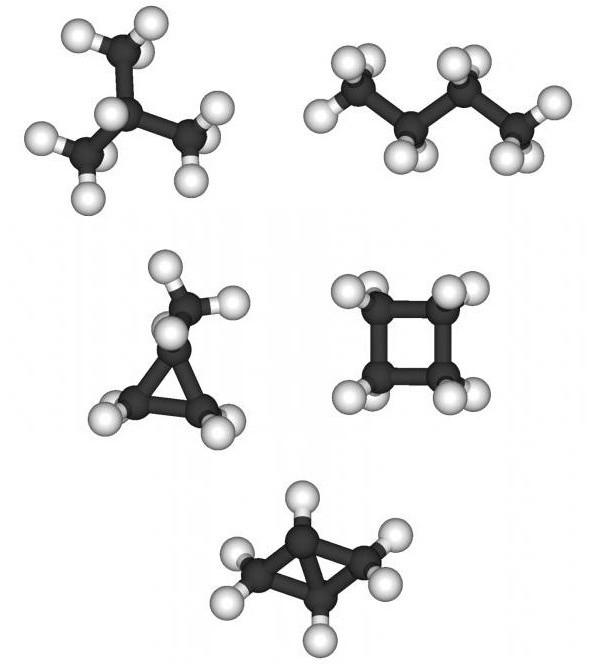
アルカンの化学的性質は、炭素原子の分子内の数だけでなく、構造からも。すべてのパラフィンは、通常(各C原子は2つ以下の炭素原子に接続できます)と等構造(C原子は他の4つのC原子に接続できます。これにより、分子は空間構造を持ちます)に分けることができます。 。たとえば、ペンタンと2,2-ジメチルプロパンの分子量と化学式は同じC5H12ですが、化学的および物理的特性が異なります。融点-129.7°Сおよびマイナス16.6°С、沸点36.1°Сおよび9.5°それぞれC。異性体は、同じ数のC原子を持つ通常の炭化水素よりも化学反応を起こしやすいです。
アルカンの特徴的な化学的性質はハロゲン化またはスルホン化を含む置換反応。温度または光の作用下でのパラフィンと塩素のラジカル反応の結果として、メタンの塩素誘導体が形成されます:クロロメタンCH3Cl、ジクロロメタンCH2Cl2、トリクロロメタンCHCl3、および四塩化炭素CCl4。アルカンがUV光によってスルホン化されると、塩化スルホニルが得られます:R – H + SO2 + Cl2→R– SO2 – Cl + HCl。これらの物質は、界面活性剤の製造に使用されます。