最も単純な有機化合物は、飽和および不飽和炭化水素です。これらには、アルカン、アルキン、アルケンのクラスの物質が含まれます。
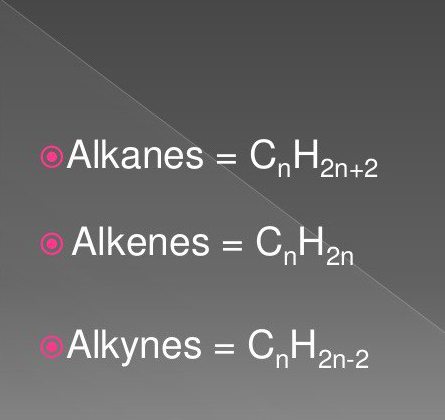
それらの式には、特定の順序と量の水素原子と炭素原子が含まれています。それらは本質的に一般的です。
アルケンの決定
それらの別の名前は、オレフィンまたはエチレン炭化水素です。これは、18世紀に油性液体-塩化エチレン-が発見されたときに、このクラスの化合物が呼び出されたものです。
アルケンには、水素および炭素元素。それらは非環式炭化水素として分類されます。それらの分子は、2つの炭素原子を互いに接続する単一の二重(不飽和)結合を含んでいます。
アルケンの式
化合物の各クラスには、独自の化学的名称があります。それらの中で、周期系の要素の記号は、各物質の結合の組成と構造を示しています。

アルケンの一般式は次のとおりです:CんX2n、ここで、数nは2以上です。解読すると、各炭素原子に2つの水素原子があることがわかります。
相同アルケンの分子式は次の構造で表されます:C2X4、C3X6, C4X8、C5X10、C6X12、C7X14、C8X16、C9X18、C10X20...後続の各炭化水素には、1つ以上の炭素と2つ以上の水素が含まれていることがわかります。
アルケンの構造式を示す、分子内の原子間の化合物の位置と順序のグラフィック指定があります。 原子価ダッシュを使用して、炭素と水素の結合が示されます。
アルケンの構造式を描くことができます展開された形式で、すべての化学元素と結合が表示されます。オレフィンのより簡潔な表現は、原子価ダッシュを使用した炭素と水素の化合物を示していません。
骨格式は最も単純な構造を示します。破線は分子のベースを表しており、炭素原子はその頂点と端で表されており、リンクは水素を示しています。
オレフィン名の形成方法
体系的な命名法に基づいて、式アルケンとその名前は、飽和炭化水素に関連するアルカンの構造で構成されています。これを行うには、後者の名前で、サフィックス-anを-ilenまたは-enに置き換えます。一例は、ブタンからのブチレンおよびペンタンからのペンテンの形成である。
炭素原子に対する二重結合の位置を示すには、名前の最後にアラビア数字を示します。
アルケンの名前は表記に基づいています二重結合を含む最長鎖炭化水素。鎖の番号付けの開始には、通常、炭素原子の不飽和化合物に最も近い端が選択されます。
アルケンの構造式が持っている場合枝は、ラジカルの名前とその番号を示し、その前に炭素鎖の場所に対応する番号が配置されます。この後には、炭化水素自体の名前が続きます。通常、番号の後にハイフンが続きます。
不飽和ラジカル分岐があります。それらの名前は、簡単なものにすることも、体系的な命名法の規則に従って形成することもできます。
たとえば、HNC = CH-はエテニルまたはビニルと呼ばれます。
異性体
アルケンの分子式は異性を示すことができません。ただし、このクラスの物質では、エチレン分子を除いて、空間的な変更が固有です。

エチレン炭化水素の異性体は、炭素骨格、不飽和結合位置、クラス間または空間的であり得る。
アルケンの一般式が量を決定します鎖内の炭素原子と水素原子ですが、二重結合の存在と位置は示されていません。例は、Cのクラス間異性体としてのシクロプロパンです。3X6 (プロピレン)。他のタイプの異性がCに現れる4X8 またはブテン。
不飽和結合の位置が異なりますブテン-1またはブテン-2、最初のケースでは、二重化合物は最初の炭素原子の近くにあり、2番目の場合は鎖の中央にあります。炭素骨格異性は、メチルプロペン(CH3-C(CH3)= CH2)およびイソブチレン((CH3)2C = CH2)
空間修飾は、ブテン-2に固有ですトランスとシスの位置。最初のケースでは、サイドラジカルは二重結合を持つ主炭素鎖の上下にあり、2番目の異性体では、置換基が片側にあります。
オレフィンの特性
アルケンの一般式は、このクラスのすべての代表者の体調を決定します。エチレンで始まりブチレンで終わる(Cから2 Cへ4)、物質はガス状で存在します。したがって、無色のエテンは甘い香りがあり、水への溶解度が低く、その分子量は空気の分子量よりも小さくなります。
液体の形態では、Cからの同族区間の炭化水素5 Cへ17...主鎖に18個の炭素原子を持つアルケンから始めて、物理的状態から固体への転移が起こります。
すべてのオレフィンは溶解度が低いと考えられています水環境ですが、ベンゼンやガソリンなどの有機溶剤に適しています。それらの分子量は水のそれよりも小さい。炭素鎖の増加は、これらの化合物の溶融および沸騰中の温度インジケーターの増加につながります。
オレフィンの性質
アルケンの構造式は、2つの炭素原子のπ-およびσ-化合物の二重結合の骨格。分子のこの構造は、その化学的性質を決定します。 π結合はあまり強くないと考えられているため、2つの原子の結合の結果として得られる2つの新しいσ結合の形成によってそれを破壊することができます。不飽和炭化水素は電子供与体です。それらは求電子付着プロセスに参加します。
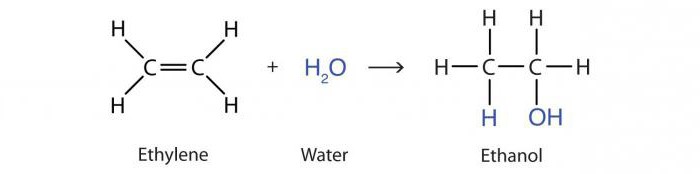
すべてのアルケンの重要な化学的性質はジハロゲン化物質のような化合物の放出を伴うハロゲン化プロセス。ハロゲン原子は炭素に二重結合することができます。例は、1,2-ジブロモプロパンを形成するためのプロピレンの臭素化です:
X2C = CH – CH3 + Br2 →BrCH2–CHBr – CH3.
アルケンで臭素水中の色を中和するこのプロセスは、二重結合の存在の質的な証拠であると考えられています。
重要な反応には、オレフィンの水素化が含まれます白金、パラジウム、ニッケルなどの触媒金属の作用下で水素分子が追加されます。結果は飽和結合を持つ炭化水素です。アルカンとアルケンの式は、ブテンの水素化反応で以下に示します。
H3–CH2–CH = CH2 + H2 Ni→CH3–CH2–CH2–CH3.
ハロゲン化水素分子をオレフィンに結合させるプロセスは、
ハロゲンハロゲン化、規則に従って通過、マルコフニコフによって発見されました。一例は、プロピレンの臭化水素化による2-ブロモプロパンの生成です。その中で、水素は炭素との二重結合と結合します。これは最も水素化されていると考えられています。
H3–CH = CH2 + HBr→CH3–BrCH – CH3.
酸の作用下でのアルケンによる水の添加の反応は、水和と呼ばれます。結果は、プロパノール-2アルコール分子です。
H3–HC = CH2 + H2O→CH3–OHCH – CH3.
アルケンが硫酸にさらされると、スルホン化プロセスが発生します。
H3–HC = CH2 + HO − OSO − OH→CH3–CH3CH – O – SO2−OH。
反応は、酸性エステル、例えばイソプロピル硫酸の形成を伴って起こる。
アルケンは、水と炭酸ガスの形成を伴う酸素の作用下での燃焼中に酸化を受けます:
2CH3–HC = CH2 + 9O2 →6CO2 + 6H2O.
オレフィン系化合物との相互作用溶液の形の希薄な過マンガン酸カリウムは、グリコールまたは二原子アルコールの形成につながります。この反応はまた、エチレングリコールの形成および溶液の変色を伴う酸化的です:
3H2C = CH2 + 4H2O + 2KMnO4 →3OHCH – CHOH + 2MnO2 + 2KOH。
アルケン分子は、フリーラジカルまたはカチオン-アニオンメカニズムで重合プロセスに関与できます。最初のケースでは、過酸化物の影響下で、ポリエチレンタイプのポリマーが得られます。
2番目のメカニズムによれば、酸はカチオン性触媒として機能し、有機金属物質はアニオンであり、立体選択性ポリマーが放出されます。
アルカンとは
彼らはまたパラフィンまたは制限とも呼ばれます非環式炭化水素。それらは飽和した単純な結合のみを含む線状または分岐構造を持っています。このクラスの相同系列のすべての代表は、一般式CんX2n + 2.
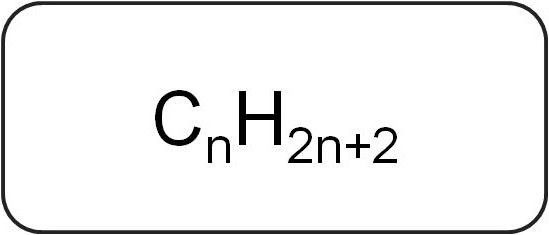
それらは炭素と水素原子のみを含んでいます。アルケンの一般式は、飽和炭化水素の表記法に基づいています。
アルカンの名前とその特徴
このクラスの最も単純な代表メタンです。その後に、エタン、プロパン、ブタンなどの物質が続きます。それらの名前は、接尾辞-anが追加されたギリシャ語の数の根に基づいています。アルカンの名前はIUPACの命名法に記載されています。
アルケン、アルキン、アルカンの一般式には、2種類の原子のみ。これらには炭素と水素の元素が含まれます。 3つのクラスすべての炭素原子数は同じで、水素の数だけに違いが見られます。水素の数は、分離または結合できます。不飽和化合物は飽和炭化水素から得られます。分子内のパラフィンの代表には、オレフィンよりも2個多い水素原子が含まれています。これは、アルカン、アルケンの一般式で確認できます。アルケン構造は二重結合の存在により不飽和であると考えられています。
アルカンの水素原子と炭素原子の数を関連付けると、他のクラスの炭化水素と比較して値が最大になります。
メタンで始まり、ブタンで終わる(Cから1 Cへ4)、物質はガス状で存在します。
液体の形態では、Cからの同族区間の炭化水素5 Cへ16...主鎖に17個の炭素原子を持つアルカンから始めて、物理状態の遷移が固体の形に発生します。
それらは、炭素骨格の異性と分子の光学的修飾によって特徴付けられます。
パラフィンでは、炭素原子価が考慮されます隣接する炭素または水素によって完全に占有され、σ型の結合を形成します。化学的見地から、これはそれらの弱い特性を引き起こします。それが、アルカンが親和性のない飽和または飽和炭化水素と呼ばれる理由です。
それらは、分子のラジカルハロゲン化、スルホ塩素化またはニトロ化に関連する置換反応に入ります。
パラフィンは高温で酸化、燃焼、または分解します。反応促進剤の作用下で、水素原子の脱離またはアルカンの脱水素が起こる。
アルキンとは
それらはアセチレン系炭化水素とも呼ばれ、炭素鎖に三重結合を持っています。アルキンの構造は、一般式Cで記述されます。んX2n – 2...これは、アルカンとは異なり、アセチレン系炭化水素には4つの水素原子がないことを示しています。それらは、2つのπ化合物によって形成される三重結合に置き換えられます。
この構造は、このクラスの化学的性質を決定します。アルケンとアルキンの構造式は、それらの分子の不飽和、および二重(H2C꞊CH2)および三重(HC≡CH)結合。
アルキンの名前とその特徴
最も単純な代表はアセチレンですまたはHC≡CH。エチンとも呼ばれます。これは、サフィックス-anが削除され、-inが追加された飽和炭化水素の名前に由来しています。長いアルキンの名前では、数字は三重結合の位置を示します。
飽和した構造と不飽和、アルキンの一般式がどの文字で指定されているかを決定することが可能です。 c)CnH2n + 2; c)CnH2n-2; d)CnH2n-6。 3番目のオプションは正解です。
アセチレンで始まり、ブタンで終わる(Cから2 Cへ4)、物質は気体の性質を持っています。

液体の形態では、Cから同族区間の炭化水素があります5 Cへ17...主鎖に18個の炭素原子を持つアルキンから始めて、物理的状態の遷移が固体の形に発生します。
それらは、炭素骨格、三重結合の位置、および分子のクラス間修飾における異性によって特徴付けられます。
化学的特性の点では、アセチレン系炭化水素はアルケンに似ています。
アルキンに末端三重結合がある場合、それらは酸として作用して、アルキニド塩、例えば、NaCaCNaを形成する。 2つのπ結合が存在すると、アセチル化ナトリウム分子は置換反応を起こす強力な求核試薬になります。
アセチレンは、塩化銅の存在下で塩素化を受けて、ジクロロアセチレン、ジアセチレン分子の放出を伴うハロアルキンの作用下での縮合が得られます。
アルキンは付加反応に関与しています求電子剤、その原理はハロゲン化、ハロゲン化水素化、水和およびカルボニル化の基礎です。ただし、このようなプロセスは、二重結合を持つアルケンのプロセスよりも弱いです。
アセチレン炭化水素の場合、アルコール、一級アミン、または硫化水素分子の求核付加反応が可能です。








