Natriumhydroksidi tai natriumhydroksidi - epäorgaaninenyhdiste, joka kuuluu emästen luokkaan tai hydroksideihin. Myös tekniikassa ja ulkomailla tätä ainetta kutsutaan kaustiseksi soodaksi. Triviaali nimi - kaustinen sooda - se sai sen voimakkaan syövyttävän vaikutuksen vuoksi.

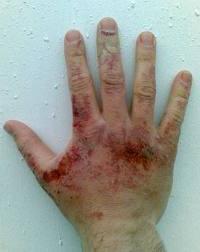
Kun se liuotetaan veteen, se muodostaa vaikuttavan aineen- alkali, - saippuaa kosketukseen. Tämä reaktio etenee hyvin nopeasti - roiskumisen ja lämmön vapautumisen myötä. Altaalin imeytyminen ihoon ja limakalvot aiheuttavat voimakkaita kemiallisia palovammoja, joten työskentelyn aikana on välttämätöntä olla varovainen ja suojata kätesi ja silmät. Jos tämä aine pääsee epiteeliin tai silmiin, suuhun, on huuhdeltava vaurioituneet alueet vedellä ja heikolla etikkahapon (2%) tai booripitoisen (3%) hapon liuoksella mahdollisimman pian ja sitten uudelleen vedellä. Hätätilanteiden hoitamisen jälkeen uhrin tulee esittää lääkärille.
Natriumhydroksidi (kemiallisen yhdisteen kaava- NaOH, stratura - Na-O-H) on reaktiivinen aine, joka voi reagoida sekä epäorgaanisten että orgaanisten aineiden kanssa. Sen havaitsemiseksi vesiliuoksissa auttaa kvalitatiivista reaktiota hydroksidi-ionille erilaisilla indikaattoreilla. Siten, lakmus indikaattori muuttuu tumman sininen, metyyli oranssi - keltainen, ja fenoliftaleiini - vadelma, jolloin värin voimakkuus riippuu alkalimetalli-.
Natriumhydroksidi pääsee tällaisiin reaktioihin:
1.neutralointi hapoilla, happooksideilla ja amfoteerisilla yhdisteillä. Tämän reaktion tulos on veden ja suolan tai hydroksokompleksin muodostuminen - jos kyseessä on vuorovaikutus amfoteeristen emästen ja oksidien kanssa;
2. vaihto suolojen kanssa;
3. Beketov-sarjassa olevien vetyatomisten metallien kanssa, joilla on alhainen sähkökemiallinen potentiaali;
4. ei-metallien ja halogeenien kanssa;
4. hydrolyysi esterien kanssa;
5. Rasvojen saippuointi (saippuat ja glyseriini muodostuvat);
6. vuorovaikutus alkoholien kanssa (aineet alkoholeatteja muodostuvat).

Myös sulassa muodossa natriumhydroksidi voi tuhota posliinia ja lasia ja saada happea jalometallia (platinaa).
Natriumhydroksidia voidaan saada aikaan sellaisilla menetelmillä:
- vesipitoisen NaCl-liuoksen elektrolyysi (kalvo ja kalvomenetelmä),
- kemiallinen (kalkkipitoinen ja ferriittinen menetelmä).
Viime vuosina elektrolyysiin perustuvia menetelmiä on käytetty useimmiten vuodesta ne ovat kannattavampia.
Kaustinen sooda käyttää suurtasuosio ja sitä käytetään monilla teollisuudenaloilla - kosmetiikka, sellu ja paperi, kemikaalit, tekstiilit, elintarvikkeet. Sitä käytetään lisäaineena Е-524, kaasujen poistoon ja biodieselpolttoaineen hankintaan.
Siten, natriumhydroksidi, - lipeää, jota on käytetty laajalti eri aloilla ihmisen toiminnasta, koska sen kemiallisesti reaktiivisen luonteen.





