Οι απλούστερες οργανικές ενώσεις είναι κορεσμένοι και ακόρεστοι υδρογονάνθρακες. Αυτές περιλαμβάνουν ουσίες της κατηγορίας αλκανίων, αλκυνών, αλκενίων.
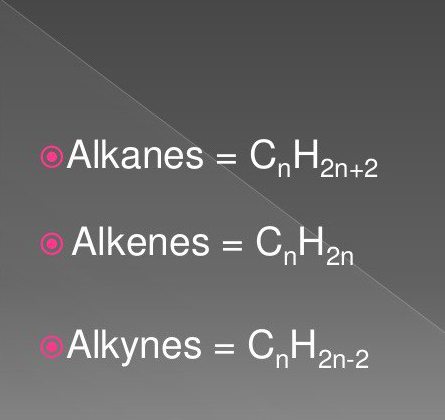
Οι τύποι τους περιλαμβάνουν άτομα υδρογόνου και άνθρακα σε μια συγκεκριμένη αλληλουχία και ποσότητα. Είναι κοινά στη φύση.
Προσδιορισμός αλκενίων
Το άλλο τους όνομα είναι οι ολεφίνες ή οι υδρογονάνθρακες αιθυλενίου. Αυτό ονομάστηκε αυτή η κατηγορία ενώσεων τον 18ο αιώνα όταν ανακαλύφθηκε ένα λιπαρό υγρό - χλωριούχο αιθυλένιο -.
Τα αλκένια περιλαμβάνουν ουσίες που αποτελούνται απόστοιχεία υδρογόνου και άνθρακα. Κατατάσσονται ως ακυκλικοί υδρογονάνθρακες. Στο μόριο τους, υπάρχει ένας μονός διπλός (ακόρεστος) δεσμός που συνδέει δύο άτομα άνθρακα μεταξύ τους.
Τύποι αλκενίων
Κάθε κατηγορία ενώσεων έχει τη δική της χημική ονομασία. Σε αυτά, τα σύμβολα των στοιχείων του περιοδικού συστήματος δείχνουν τη σύνθεση και τη δομή του δεσμού κάθε ουσίας.

Ο γενικός τύπος αλκενίων αναφέρεται ως εξής: ΓnΧ2η, όπου ο αριθμός n είναι μεγαλύτερος ή ίσος με 2. Όταν αποκρυπτογραφείται, είναι σαφές ότι για κάθε άτομο άνθρακα υπάρχουν δύο άτομα υδρογόνου.
Οι μοριακοί τύποι ομόλογων αλκενίων αντιπροσωπεύονται από τις ακόλουθες δομές: Γ2Χ4, Γ3Χ6, ντο4Χ8, Γ5Χ10, Γ6Χ12, Γ7Χ14, Γ8Χ16, Γ9Χ18, Γ10Χ20... Μπορεί να φανεί ότι κάθε επόμενος υδρογονάνθρακας περιέχει έναν ακόμη άνθρακα και 2 περισσότερο υδρογόνο.
Υπάρχει μια γραφική ονομασία της θέσης και της σειράς των χημικών ενώσεων μεταξύ ατόμων σε ένα μόριο, που δείχνει τον συντακτικό τύπο των αλκενίων. Με τη βοήθεια παύσεων σθένους, υποδεικνύεται ο δεσμός μεταξύ άνθρακα και υδρογόνων.
Ο συντακτικός τύπος αλκενίων μπορεί να απεικονιστείσε εκτεταμένη μορφή, όταν εμφανίζονται όλα τα χημικά στοιχεία και οι δεσμοί. Η πιο περιεκτική έκφραση για τις ολεφίνες δεν δείχνει την ένωση του άνθρακα και του υδρογόνου χρησιμοποιώντας παύλες σθένους.
Ο σκελετικός τύπος υποδηλώνει την απλούστερη δομή. Η σπασμένη γραμμή αντιπροσωπεύει τη βάση του μορίου, στην οποία τα άτομα άνθρακα αντιπροσωπεύονται από τις κορυφές και τα άκρα του, και οι σύνδεσμοι υποδεικνύουν υδρογόνο.
Πώς σχηματίζονται τα ονόματα ολεφινών
Με βάση τη συστηματική ονοματολογία, τον τύποαλκένια και τα ονόματά τους αποτελούνται από τη δομή των αλκανίων που σχετίζονται με κορεσμένους υδρογονάνθρακες. Για να γίνει αυτό, στο όνομα του τελευταίου, το επίθημα -an αντικαθίσταται από -ilen ή -en. Ένα παράδειγμα είναι ο σχηματισμός βουτυλενίου από βουτάνιο και πεντενίου από πεντάνιο.
Για να υποδείξετε τη θέση ενός διπλού δεσμού σε σχέση με τα άτομα άνθρακα, σημειώστε έναν αραβικό αριθμό στο τέλος του ονόματος.
Το όνομα των αλκενίων βασίζεται στον συμβολισμότον υδρογονάνθρακα μακρύτερης αλυσίδας στον οποίο υπάρχει διπλός δεσμός. Για την αρχή της αρίθμησης της αλυσίδας, επιλέγεται συνήθως το άκρο που βρίσκεται πλησιέστερα στην ακόρεστη ένωση ατόμων άνθρακα.
Εάν ο δομικός τύπος των αλκενίων έχειυποκαταστήματα, στη συνέχεια υποδείξτε τα ονόματα των ριζών και τον αριθμό τους, και μπροστά τους βάζουν αριθμούς που αντιστοιχούν στη θέση στην αλυσίδα άνθρακα. Ακολουθεί το όνομα του ίδιου του υδρογονάνθρακα. Οι αριθμοί ακολουθούνται συνήθως από παύλα.
Υπάρχουν ακόρεστοι ριζικοί κλάδοι. Τα ονόματά τους μπορεί να είναι ασήμαντα ή να διαμορφώνονται σύμφωνα με τους κανόνες της συστηματικής ονοματολογίας.
Για παράδειγμα, το HNC = CH- αναφέρεται ως αιθενύλιο ή βινύλιο.
Ισομερή
Οι μοριακοί τύποι αλκενίων δεν μπορούν να δείξουν ισομερισμό. Ωστόσο, για αυτήν την κατηγορία ουσιών, με εξαίρεση το μόριο αιθυλενίου, η χωρική τροποποίηση είναι εγγενής.

Τα ισομερή των αιθυλενικών υδρογονανθράκων μπορεί να είναι σκελετός άνθρακα, ακόρεστη θέση δεσμού, ενδιάμεση κλάση ή χωρική.
Ο γενικός τύπος των αλκενίων καθορίζει την ποσότηταάτομα άνθρακα και υδρογόνου στην αλυσίδα, αλλά δεν δείχνει την παρουσία και τη θέση του διπλού δεσμού. Ένα παράδειγμα είναι το κυκλοπροπάνιο ως ένα ισομερές interclass του C3Χ6 (προπυλένιο). Άλλοι τύποι ισομερισμού εμφανίζονται στο C4Χ8 ή βουτένιο.
Παρατηρείται διαφορετική θέση ακόρεστης σύνδεσης στοβουτένιο-1 ή βουτένιο-2, στην πρώτη περίπτωση η διπλή ένωση βρίσκεται κοντά στο πρώτο άτομο άνθρακα και στη δεύτερη - στη μέση της αλυσίδας. Ο ισομερισμός του σκελετού άνθρακα μπορεί να θεωρηθεί ότι χρησιμοποιεί μεθυλοπροπένιο (CH3-C (CH3) = CH2) και ισοβουτυλένιο ((CH3) 2C = CH2).
Η χωρική τροποποίηση είναι εγγενής στο βουτένιο-2 intrans και θέση cis. Στην πρώτη περίπτωση, οι πλευρικές ρίζες βρίσκονται πάνω και κάτω από την κύρια αλυσίδα άνθρακα με διπλό δεσμό, στο δεύτερο ισομερές, οι υποκαταστάτες βρίσκονται στη μία πλευρά.
Χαρακτηρισμός των ολεφινών
Ο γενικός τύπος των αλκενίων καθορίζει τη φυσική κατάσταση όλων των εκπροσώπων αυτής της τάξης. Ξεκινώντας με αιθυλένιο και τελειώνοντας με βουτυλένιο (από Γ2 στο Γ4), οι ουσίες υπάρχουν σε αέρια μορφή. Έτσι, το άχρωμο αιθένιο έχει μια γλυκιά οσμή, χαμηλή διαλυτότητα στο νερό και το μοριακό του βάρος είναι μικρότερο από αυτό του αέρα.
Σε υγρή μορφή, υδρογονάνθρακες του ομόλογου διαστήματος από C5 στο Γ17... Ξεκινώντας με αλκένιο, το οποίο έχει 18 άτομα άνθρακα στην κύρια αλυσίδα, πραγματοποιείται μετάβαση της φυσικής κατάστασης σε στερεά μορφή.
Όλες οι ολεφίνες θεωρείται ότι έχουν χαμηλή διαλυτότητα στοπεριβάλλον νερού, αλλά καλό σε οργανικούς διαλύτες, όπως βενζόλιο ή βενζίνη. Το μοριακό τους βάρος είναι μικρότερο από αυτό του νερού. Μια αύξηση στην αλυσίδα άνθρακα οδηγεί σε αύξηση των δεικτών θερμοκρασίας κατά τη διάρκεια της τήξης και του βρασμού αυτών των ενώσεων.
Ιδιότητες ολεφινών
Ο συντακτικός τύπος των αλκενίων δείχνει την παρουσία στοο σκελετός ενός διπλού δεσμού των π- και σ- ενώσεων δύο ατόμων άνθρακα. Αυτή η δομή του μορίου καθορίζει τις χημικές του ιδιότητες. Ο π-δεσμός θεωρείται όχι πολύ ισχυρός, γεγονός που καθιστά δυνατή την καταστροφή του με το σχηματισμό δύο νέων σ-δεσμών, οι οποίοι λαμβάνονται ως αποτέλεσμα της προσάρτησης ενός ζεύγους ατόμων. Οι ακόρεστοι υδρογονάνθρακες είναι ηλεκτρονικοί δότες. Συμμετέχουν σε διαδικασίες ηλεκτροφιλικής προσκόλλησης.
Μια σημαντική χημική ιδιότητα όλων των αλκενίων είναιμια διαδικασία αλογόνωσης με την απελευθέρωση ενώσεων όπως οι διαλογωμένες ουσίες Τα άτομα αλογόνου είναι ικανά διπλής σύνδεσης με άνθρακες. Ένα παράδειγμα είναι η βρωμίωση του προπυλενίου για το σχηματισμό 1,2-διβρωμοπροπανίου:
Χ2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Αυτή η διαδικασία εξουδετέρωσης χρώματος σε νερό βρωμίου με αλκένια θεωρείται ποιοτική απόδειξη της παρουσίας ενός διπλού δεσμού.
Σημαντικές αντιδράσεις περιλαμβάνουν την υδρογόνωση των ολιφινώνμε την προσθήκη ενός μορίου υδρογόνου υπό τη δράση καταλυτικών μετάλλων όπως πλατίνα, παλλάδιο ή νικέλιο. Το αποτέλεσμα είναι υδρογονάνθρακες με κορεσμένο δεσμό. Οι τύποι αλκανίων, αλκενίων δίδονται παρακάτω στην υδρογόνωση του βουτενίου:
H3–CH2–CH = CH2 + Χ2 Νι→ CH3–CH2–CH2–CH3.
Η διαδικασία προσάρτησης ενός μορίου αλογονιδίου υδρογόνου σε ολεφίνες καλείται
υδροαλογόνωση, που λαμβάνει χώρα σύμφωνα με τον κανόνα,ανακαλύφθηκε από τον Markovnikov. Ένα παράδειγμα είναι η υδροβρωμίωση του προπυλενίου προς σχηματισμό 2-βρωμοπροπανίου. Σε αυτό, το υδρογόνο συνδυάζεται με έναν διπλό δεσμό με άνθρακα, ο οποίος θεωρείται ο πιο υδρογονωμένος:
H3–CH = CH2 + HBr → CH3–BrCH - CH3.
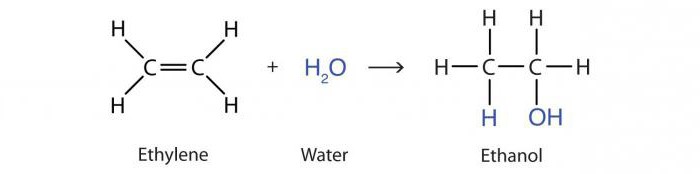
Η αντίδραση προσθήκης νερού από αλκένια υπό τη δράση οξέων ονομάζεται ενυδάτωση Το αποτέλεσμα είναι ένα μόριο αλκοόλης προπανόλης-2:
H3–HC = CH2 + Χ2O → CH3–OHCH - CH3.
Όταν τα αλκένια εκτίθενται σε θειικό οξύ, η διαδικασία σουλφονίωσης συμβαίνει:
H3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2−ΟΗ.
Η αντίδραση λαμβάνει χώρα με το σχηματισμό όξινων εστέρων, για παράδειγμα, ισοπροπυλοσουλφικού οξέος.
Τα αλκένια είναι ευαίσθητα στην οξείδωση κατά την καύση τους υπό τη δράση του οξυγόνου για να σχηματίσουν νερό και αέριο διοξείδιο του άνθρακα:
2CH3–HC = CH2 + 9Ο2 → 6CO2 + 6Η2Ο.
Η αλληλεπίδραση των ολεφινικών ενώσεων καιΤο αραιό υπερμαγγανικό κάλιο με τη μορφή διαλύματος οδηγεί στο σχηματισμό γλυκολών ή διατομικών αλκοολών. Αυτή η αντίδραση είναι επίσης οξειδωτική με το σχηματισμό αιθυλενογλυκόλης και αποχρωματισμού διαλύματος:
3Η2C = CH2 + 4Η2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Τα μόρια αλκενίων μπορούν να εμπλέκονται στον πολυμερισμό με έναν ελεύθερο ριζικό ή κατιονικό-ανιονικό μηχανισμό. Στην πρώτη περίπτωση, υπό την επίδραση υπεροξειδίων, λαμβάνεται ένα πολυμερές τύπου πολυαιθυλενίου.
Σύμφωνα με τον δεύτερο μηχανισμό, τα οξέα δρουν ως κατιονικοί καταλύτες και οι οργανομεταλλικές ουσίες είναι ανιονικές με την απελευθέρωση ενός στερεοεπιλεκτικού πολυμερούς.
Τι είναι τα αλκάνια
Ονομάζονται επίσης παραφίνες ή περιοριστικέςακυκλικοί υδρογονάνθρακες. Έχουν γραμμική ή διακλαδισμένη δομή, η οποία περιέχει μόνο κορεσμένους απλούς δεσμούς. Όλοι οι εκπρόσωποι της ομόλογης σειράς αυτής της τάξης έχουν τον γενικό τύπο ΓnΧ2n + 2.
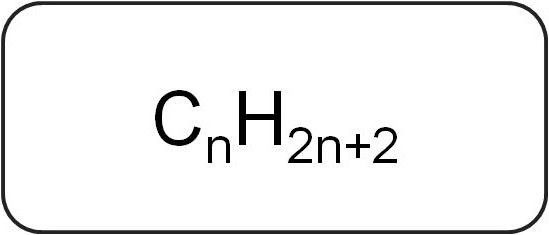
Περιέχουν μόνο άτομα άνθρακα και υδρογόνου. Ο γενικός τύπος για τα αλκένια προέρχεται από τη σημείωση των κορεσμένων υδρογονανθράκων.
Τα ονόματα των αλκανίων και τα χαρακτηριστικά τους
Ο απλούστερος εκπρόσωπος αυτής της τάξηςείναι μεθάνιο. Ακολουθείται από ουσίες όπως αιθάνιο, προπάνιο και βουτάνιο. Το όνομά τους βασίζεται στη ρίζα ενός αριθμού στα ελληνικά, στον οποίο προστίθεται το επίθημα -an. Τα ονόματα των αλκανίων παρατίθενται στην ονοματολογία IUPAC.
Ο γενικός τύπος για αλκένια, αλκύνια, αλκάνια περιλαμβάνειμόνο δύο είδη ατόμων. Αυτά περιλαμβάνουν τα στοιχεία άνθρακα και υδρογόνο. Ο αριθμός των ατόμων άνθρακα και στις τρεις κατηγορίες είναι ο ίδιος, η διαφορά παρατηρείται μόνο στον αριθμό του υδρογόνου, το οποίο μπορεί να διαχωριστεί ή να συνδεθεί. Οι ακόρεστες ενώσεις λαμβάνονται από κορεσμένους υδρογονάνθρακες. Οι εκπρόσωποι των παραφινών στο μόριο περιέχουν 2 περισσότερα άτομα υδρογόνου από τις ολεφίνες, κάτι που επιβεβαιώνεται από τον γενικό τύπο αλκανίων, αλκενίων. Η δομή των αλκενίων θεωρείται ακόρεστη λόγω της παρουσίας ενός διπλού δεσμού.
Εάν συσχετίσουμε τον αριθμό ατόμων υδρογόνου και άνθρακα στα αλκάνια, τότε η τιμή θα είναι μέγιστη σε σύγκριση με άλλες κατηγορίες υδρογονανθράκων.
Ξεκινώντας με μεθάνιο και τελειώνοντας με βουτάνιο (από C1 στο Γ4), οι ουσίες υπάρχουν σε αέρια μορφή.
Σε υγρή μορφή, υδρογονάνθρακες του ομόλογου διαστήματος από C5 στο Γ16... Ξεκινώντας με ένα αλκάνιο, το οποίο έχει 17 άτομα άνθρακα στην κύρια αλυσίδα, πραγματοποιείται μετάβαση της φυσικής κατάστασης σε στερεά μορφή.
Χαρακτηρίζονται από ισομερισμό στον σκελετό άνθρακα και οπτικές τροποποιήσεις του μορίου.
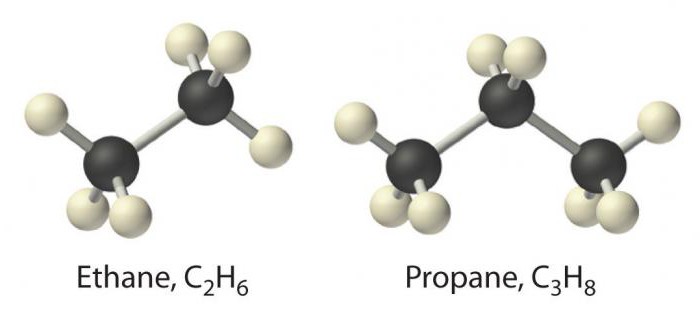
Στις παραφίνες, θεωρούνται σθένη άνθρακακαταλαμβάνεται πλήρως από γειτονικούς άνθρακες ή υδρογόνα με το σχηματισμό ενός δεσμού τύπου σ. Από χημική άποψη, αυτό καθορίζει τις αδύναμες ιδιότητές τους, και γι 'αυτό τα αλκάνια ονομάζονται κορεσμένοι ή κορεσμένοι υδρογονάνθρακες, χωρίς συγγένεια.
Εισέρχονται σε αντιδράσεις υποκατάστασης που σχετίζονται με ριζική αλογόνωση, σουλφοχλωρίωση ή νίτρωση του μορίου.
Οι παραφίνες υφίστανται οξείδωση, καύση ή αποσύνθεση σε υψηλές θερμοκρασίες. Υπό τη δράση των επιταχυντών αντίδρασης, τα άτομα υδρογόνου απομακρύνονται ή τα αλκάνια αφυδατώνονται.
Τι είναι τα αλκύνια
Ονομάζονται επίσης ακετυλενικοί υδρογονάνθρακες, οι οποίοι έχουν τριπλό δεσμό στην αλυσίδα άνθρακα. Η δομή των αλκυνών περιγράφεται από τον γενικό τύπο CnΧ2n - 2... Από αυτό μπορεί να φανεί ότι, σε αντίθεση με τα αλκάνια, οι ακετυλενικοί υδρογονάνθρακες δεν διαθέτουν τέσσερα άτομα υδρογόνου. Αντικαθίστανται από έναν τριπλό δεσμό που σχηματίζεται από δύο π-ενώσεις.
Αυτή η δομή καθορίζει τις χημικές ιδιότητες αυτής της κατηγορίας. Ο συντακτικός τύπος των αλκενίων και των αλκυνών δείχνει σαφώς τον ακόρεστο των μορίων τους, καθώς και την παρουσία ενός διπλού (H2C꞊CH2) και τριπλά (HC≡CH) ομόλογα.
Το όνομα των αλκυνών και τα χαρακτηριστικά τους
Ο απλούστερος αντιπρόσωπος είναι το ακετυλένιοή HC≡CH. Ονομάζεται επίσης αιθίνη. Προέρχεται από το όνομα ενός κορεσμένου υδρογονάνθρακα, στον οποίο το επίθημα -α αφαιρείται και προστίθεται -in. Στα ονόματα των μακρών αλκυνών, ο αριθμός δείχνει τη θέση του τριπλού δεσμού.
Γνωρίζοντας τη δομή των κορεσμένων καιακόρεστα, είναι δυνατόν να προσδιοριστεί με ποιο γράμμα αναφέρεται ο γενικός τύπος αλκυνών: α) CnH2n; γ) CnH2n + 2; γ) CnH2n-2; δ) CnH2n-6. Η τρίτη επιλογή είναι η σωστή απάντηση.
Ξεκινώντας με ακετυλένιο και τελειώνοντας με βουτάνιο (από C2 στο Γ4), οι ουσίες έχουν αέρια φύση

Σε υγρή μορφή, υπάρχουν υδρογονάνθρακες του ομόλογου διαστήματος από το C5 στο Γ17... Ξεκινώντας με αλκύνιο, το οποίο έχει 18 άτομα άνθρακα στην κύρια αλυσίδα, μια μετάβαση της φυσικής κατάστασης λαμβάνει χώρα σε μια στερεή μορφή.
Χαρακτηρίζονται από ισομερισμό στον σκελετό του άνθρακα, στη θέση του τριπλού δεσμού, καθώς και από τροποποιήσεις μεταξύ μορίων του μορίου.
Όσον αφορά τα χημικά χαρακτηριστικά, οι ακετυλενικοί υδρογονάνθρακες είναι παρόμοιοι με τα αλκένια.
Εάν το alkyne έχει τερματικό τριπλό δεσμό, τότε αυτοίδρουν ως ένα οξύ για να σχηματίσουν αλκυνικά άλατα, για παράδειγμα NaC2CNa. Η παρουσία δύο δεσμών π καθιστά το μόριο του ακετυλενίου νατρίου ένα ισχυρό πυρηνόφιλο που εισέρχεται σε αντιδράσεις υποκατάστασης.
Το ακετυλένιο υφίσταται χλωρίωση παρουσία χλωριούχου χαλκού για να ληφθεί διχλωροακετυλένιο, συμπύκνωση υπό τη δράση αλοαλκυνών με την απελευθέρωση μορίων διακετυλενίου.
Οι αλκίνες εμπλέκονται σε επιπλέον αντιδράσειςηλεκτροφιλικό, η αρχή του οποίου είναι η βάση της αλογόνωσης, της υδροαλογονώσεως, της ενυδάτωσης και της καρβονυλίωσης. Ωστόσο, τέτοιες διεργασίες είναι ασθενέστερες από αυτές των αλκενίων με διπλό δεσμό.
Για ακετυλενικούς υδρογονάνθρακες, είναι δυνατές αντιδράσεις πυρηνόφιλης προσθήκης της αλκοόλης, πρωτοταγούς αμίνης ή υδρόθειου.








