Podle Oparin-Haldane teorie život na naší planetěvznikl z koacervátové kapky. Byla také molekulou proteinu. To znamená, že z toho vyplývá, že právě tyto chemické sloučeniny jsou základem všeho živého, co dnes existuje. Ale co jsou proteinové struktury? Jakou roli dnes hrají v těle a životě lidí? Jaké druhy proteinů existují? Zkusme na to přijít.

Bílkoviny: obecný pojem
Z hlediska chemické struktury je molekula dané látky sekvencí aminokyselin spojených peptidovými vazbami.
Každá aminokyselina má dvě funkční skupiny:
- karboxy-COOH;
- aminoskupina -NH2.
Právě mezi nimi se vytváří spojení.v různých molekulách. Peptidová vazba je tedy -CO-NH. Molekula proteinu může obsahovat stovky a tisíce takových skupin, to bude záviset na konkrétní látce. Druhy proteinů jsou velmi rozmanité. Mezi nimi jsou ty, které obsahují esenciální aminokyseliny pro tělo, což znamená, že musí vstoupit do těla s jídlem. Existují odrůdy, které plní důležité funkce v buněčné membráně a cytoplazmě. Izolují se také katalyzátory biologické povahy - enzymy, což jsou také molekuly bílkovin. Jsou široce používány v lidském životě a nejen se podílejí na biochemických procesech živých věcí.
Molekulová hmotnost uvažovaných sloučeninse může pohybovat v řádu desítek až milionů. Počet monomerních jednotek ve velkém polypeptidovém řetězci je skutečně neomezený a závisí na typu konkrétní látky. Čistý protein ve své přirozené konformaci lze vidět při pohledu na syrové slepičí vejce. Světle žlutá, průhledná hustá koloidní hmota, uvnitř které se nachází žloutek - to je požadovaná látka. Totéž lze říci o beztučném tvarohu. Tento produkt je také prakticky čistý protein ve své přirozené formě.
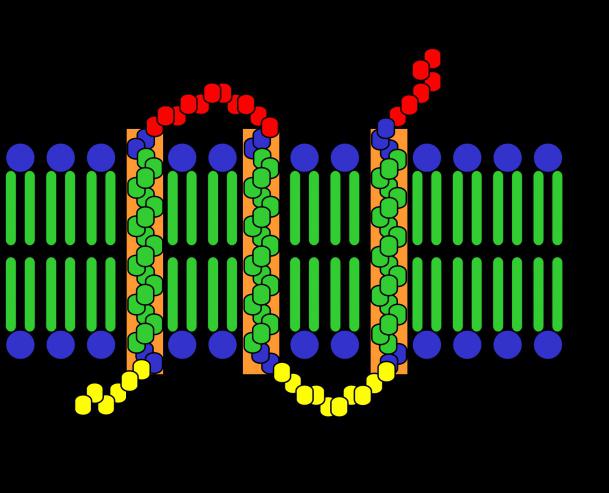
Ne všechny uvažované sloučeniny však majístejná prostorová struktura. Celkem existují čtyři organizace molekuly. Typy proteinových struktur určují jeho vlastnosti a indikují složitost struktury. Je také známo, že více prostorově propletené molekuly jsou důkladně zpracovány u lidí a zvířat.
Typy proteinových struktur
Jsou čtyři. Podívejme se, jaký je každý z nich.
- Hlavní.Představuje obvyklou lineární sekvenci aminokyselin spojených peptidovými vazbami. Nejsou zde žádné prostorové zvraty ani spirály. Počet jednotek zahrnutých v polypeptidu může být až několik tisíc. Typy proteinů s podobnou strukturou - glycylalanin, inzulín, histony, elastin a další.
- Sekundární.Skládá se ze dvou polypeptidových řetězců, které se stáčejí do spirály a jsou k sobě orientovány vytvořenými závity. V tomto případě mezi nimi vznikají vodíkové vazby, které je drží pohromadě. Tak vzniká jediná molekula proteinu. Typy proteinů tohoto typu jsou následující: lysozym, pepsin a další.
- Terciární konformace.Je to těsně zabalená sekundární struktura kompaktně shromážděná do koule. Zde se objevují kromě vodíkových vazeb i další typy interakcí - jedná se o van der Waalsovy interakce a elektrostatické přitažlivé síly, hydrofilně-hydrofobní kontakt. Příklady struktur jsou albumin, fibroin, hedvábný protein a další.
- Kvartérní.Nejsložitější struktura, což je několik polypeptidových řetězců stočených do spirály, stočených do koule a spojených dohromady do globule. Příklady jako inzulín, feritin, hemoglobin, kolagen ilustrují právě takovou konformaci proteinů.
Pokud vezmeme v úvahu všechny výše uvedené strukturymolekuly podrobně z chemického hlediska, pak bude analýza trvat dlouho. Ve skutečnosti platí, že čím vyšší je konfigurace, čím složitější a složitější je její struktura, tím více typů interakcí je v molekule pozorováno.

Denaturace proteinových molekul
Jedna z nejdůležitějších chemických vlastnostípolypeptidy je jejich schopnost degradovat pod vlivem určitých podmínek nebo chemických činidel. Rozšířené jsou například různé typy denaturace bílkovin. co je to za proces? Spočívá v destrukci přirozené struktury proteinu. To znamená, že pokud původně molekula měla terciární strukturu, pak po působení speciálních činidel bude zničena. Sekvence aminokyselinových zbytků však zůstává v molekule nezměněna. Denaturované bílkoviny rychle ztrácejí své fyzikální a chemické vlastnosti.
Jaká činidla jsou schopna vést k procesu destrukce konformace? Je jich několik.
- Teplota.Při zahřívání dochází k postupné destrukci kvartérní, terciární, sekundární struktury molekuly. To lze vizuálně pozorovat například při smažení obyčejného slepičího vejce. Výsledný "protein" je primární strukturou albuminového polypeptidu, který byl přítomen v surovém produktu.
- Záření.
- Působení silnými chemickými činidly: kyseliny, zásady, soli těžkých kovů, rozpouštědla (například alkoholy, ethery, benzen a další).
Tento proces se někdy také nazývá tavení.molekul. Typy denaturace bílkovin závisí na látce, pod jejímž působením k ní došlo. V tomto případě v některých případech probíhá proces opačný než uvažovaný. Toto je renaturace. Ne všechny proteiny jsou schopny obnovit svou strukturu zpět, ale významná část z nich to dokáže. Chemici z Austrálie a Ameriky tedy provedli renaturaci vařeného kuřecího vejce pomocí některých činidel a odstřeďovací metody.
Tento proces je důležitý pro živé organismy při syntéze polypeptidových řetězců ribozomy a rRNA v buňkách.

Hydrolýza molekul bílkovin
Spolu s denaturací se proteiny vyznačují takéjednou chemickou vlastností je hydrolýza. To je také destrukce nativní konformace, ale ne na primární strukturu, ale úplně na jednotlivé aminokyseliny. Důležitou součástí trávení je hydrolýza bílkovin. Typy hydrolýzy polypeptidů jsou následující.
- Chemikálie. Na základě působení kyselin nebo zásad.
- Biologické nebo enzymatické.
Podstata procesu však zůstává nezměněna a nemění sezávisí na tom, jaké typy hydrolýzy bílkovin probíhají. V důsledku toho se tvoří aminokyseliny, které jsou transportovány všemi buňkami, orgány a tkáněmi. Jejich další transformace spočívá v účasti syntézy nových polypeptidů, již těch, které jsou pro konkrétní organismus nezbytné.
V průmyslu se proces hydrolýzy proteinových molekul používá právě k získání požadovaných aminokyselin.

Funkce bílkovin v těle
Různé druhy bílkovin, sacharidů, tuků jsouživotně důležité složky pro normální fungování jakékoli buňky. To znamená celý organismus jako celek. Proto je jejich role z velké části způsobena vysokým stupněm důležitosti a všudypřítomnosti v živých bytostech. Lze rozlišit několik základních funkcí polypeptidových molekul.
- Katalytické. Provádějí ho enzymy, které mají proteinovou strukturu. Budeme o nich mluvit později.
- Strukturální.Druhy bílkovin a jejich funkce v těle ovlivňují především stavbu samotné buňky, její tvar. Polypeptidy, které plní tuto roli, navíc tvoří vlasy, nehty, lastury měkkýšů a ptačí peří. Jsou také určitou armaturou v těle buňky. Chrupavka se také skládá z těchto typů bílkovin. Příklady: tubulin, keratin, aktin a další.
- Regulační.Tato funkce se projevuje účastí polypeptidů na takových procesech, jako je: transkripce, translace, buněčný cyklus, sestřih, čtení mRNA a další. Ve všech hrají důležitou roli dispečera.
- Signál.Tuto funkci plní proteiny umístěné na buněčné membráně. Přenášejí různé signály z jedné jednotky do druhé, a to vede ke vzájemné komunikaci tkání. Příklady: cytokiny, inzulín, růstové faktory a další.
- Doprava.Některé druhy bílkovin a jejich funkce, které plní, jsou prostě životně důležité. To se děje například u bílkoviny hemoglobin. Přenáší kyslík z buňky do buňky v krvi. Pro člověka je nenahraditelný.
- Náhradní nebo záložní. Takové polypeptidy se hromadí v rostlinách a vejcích zvířat jako zdroj dodatečné výživy a energie. Příkladem jsou globuliny.
- Motor.Velmi důležitá funkce zejména pro nejjednodušší organismy a bakterie. Koneckonců, jsou schopni se pohybovat pouze pomocí bičíků nebo řasinek. A tyto organely nejsou od přírody nic jiného než proteiny. Příklady takových polypeptidů jsou následující: myosin, aktin, kinesin a další.
Je zřejmé, že funkce bílkovin v lidském tělea další živé bytosti jsou velmi početné a důležité. To opět potvrzuje, že bez sloučenin, o kterých uvažujeme, je život na naší planetě nemožný.

Ochranná funkce bílkovin
Polypeptidy mohou chránit před různými vlivy:chemické, fyzikální, biologické. Například, pokud je tělo ohroženo virem nebo bakterií cizí povahy, pak s nimi přicházejí do boje imunoglobuliny (protilátky), které plní ochrannou roli.
Pokud se budeme bavit o fyzikálních účincích, tak významnou roli hrají například fibrin a fibrinogen, které se podílejí na srážení krve.
Potravinové proteiny
Typy dietních bílkovin jsou následující:
- plnohodnotné - ty, které obsahují všechny aminokyseliny nezbytné pro tělo;
- defektní - ty, ve kterých je neúplné složení aminokyselin.
Obojí je však pro lidský organismus důležité.Zejména první skupina. Každý, zvláště v období intenzivního vývoje (dětství a dospívání) a puberty, si v sobě musí udržovat stálou hladinu bílkovin. Ostatně, funkce, které tyto úžasné molekuly plní, jsme již prozkoumali a víme, že prakticky ani jeden proces, ani jedna biochemická reakce v nás není dokončena bez účasti polypeptidů.
Proto je nutné každý den konzumovat denní příjem bílkovin, které jsou obsaženy v následujících potravinách:
- vejce;
- mléko;
- tvaroh;
- maso a ryba;
- fazole;
- sója;
- fazole;
- arašíd;
- pšenice;
- oves;
- čočka a další.
Pokud konzumujete 0,6 g polypeptidu denně na jedenkg hmotnosti, pak nebude mít člověk nikdy nedostatek těchto sloučenin. Pokud tělo delší dobu nedostává potřebné bílkoviny, pak dochází k onemocnění, kterému se říká hladovění aminokyselin. To vede k těžkým metabolickým poruchám a v důsledku toho k mnoha dalším neduhům.

Bílkoviny v buňce
Uvnitř nejmenší konstrukční jednotky všehoživé – buňky – jsou také bílkoviny. Navíc tam plní téměř všechny výše uvedené funkce. Nejprve se vytvoří cytoskelet buňky, který se skládá z mikrotubulů, mikrofilament. Slouží k udržení tvaru a také k transportu uvnitř mezi organelami. Různé ionty a sloučeniny se pohybují podél proteinových molekul, jako jsou kanály nebo kolejnice.
Role proteinů ponořených do membrány aumístěný na jeho povrchu. Zde plní jak receptorové, tak signalizační funkce a podílejí se na stavbě samotné membrány. Jsou ve střehu, což znamená, že hrají ochrannou roli. Jaké typy bílkovin v buňce lze přiřadit k této skupině? Příkladů je mnoho, zde je několik.
- Aktin a myosin.
- Elastin.
- Keratin.
- Kolagen.
- Tubulin.
- Hemoglobin.
- Inzulín.
- transkobalamin.
- transferin.
- Bílek.
Celkem existuje několik stovek různých typů proteinů, které se neustále pohybují v každé buňce.
Typy bílkovin v těle
Těch je samozřejmě obrovské množství. Pokud se pokusíte nějak rozdělit všechny existující proteiny do skupin, můžete získat něco jako tuto klasifikaci.
- Globulární proteiny.Jsou to ty, které jsou reprezentovány terciární strukturou, tedy hustě zabalenou globulí. Příklady takových struktur jsou následující: imunoglobuliny, významná část enzymů, mnoho hormonů.
- Fibrilární proteiny.Jsou to přísně uspořádané závity se správnou prostorovou symetrií. Do této skupiny patří proteiny s primární a sekundární strukturou. Například keratin, kolagen, tropomyosin, fibrinogen.
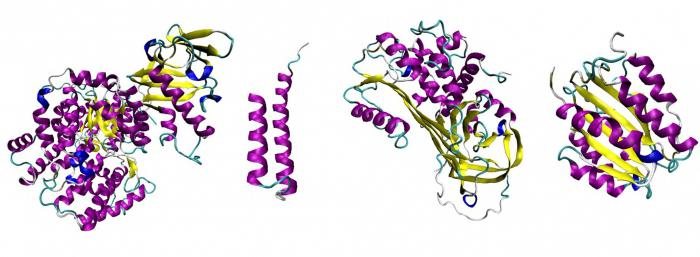
Obecně platí, že za základ pro klasifikaci proteinů nacházejících se v těle můžete vzít mnoho znaků. Jeden zatím neexistuje.
Enzymy
Biologické katalyzátory proteinové povahy,které výrazně urychlují všechny probíhající biochemické procesy. Normální metabolismus je bez těchto sloučenin prostě nemožný. Všechny procesy syntézy a rozpadu, skládání molekul a jejich replikace, translace a transkripce a další probíhají pod vlivem specifického typu enzymu. Příklady těchto molekul zahrnují:
- oxidoreduktáza;
- transferáza;
- kataláza;
- hydrolázy;
- izomeráza;
- lyázy a další.
Dnes se enzymy používají v každodenním životě.Takže při výrobě pracích prášků se často používají takzvané enzymy – to jsou biologické katalyzátory. Zlepšují kvalitu praní při zachování stanoveného teplotního režimu. Snadno se naváže na částice nečistot a odstraní je z povrchu tkanin.
Vzhledem k proteinové povaze však enzymy nesnášejí příliš horkou vodu nebo blízkost alkalických nebo kyselých přípravků. V tomto případě skutečně dojde k procesu denaturace.









