Uzun bir süre, bilim adamları tek birmoleküllerin yapısını açıklayan bir teori, diğer maddelere göre özelliklerini açıklar. Bunu yapmak için atomun doğasını ve yapısını tanımlamak, "değerlik", "elektron yoğunluğu" ve diğer pek çok kavramları tanıtmak zorundaydılar.
Teori teorisi

Maddelerin kimyasal yapısı ilk ilgilendiİtalyanca Amadeus Avogadro. Çeşitli gazların moleküllerinin ağırlığını incelemeye başladı ve gözlemlerine dayanarak yapıları hakkında bir hipotez ortaya koydu. Ancak önce rapor vermeye başlamadı, ancak meslektaşlarının benzer sonuçlar almasını bekledi. Bundan sonra, gazların moleküler ağırlığını elde etme yöntemi Avogadro yasası olarak bilinir hale geldi.
Yeni teori, diğer bilim adamlarını araştırmaya itti. Bunların arasında Lomonosov, Dalton, Lavoisier, Proust, Mendeleev ve Butlerov vardı.
Butlerov'un teorisi

"Kimyasal yapı teorisi" ifadesiilk olarak 1861'de Almanya'da Butlerov tarafından temsil edilen maddelerin yapısı hakkında bir raporda yer aldı. Sonraki yayınlarda değişmedi ve bilim tarihinin yıllıklarına yerleşti. Bu, birkaç yeni teorinin habercisi oldu. Belgesinde, bilim adamı maddelerin kimyasal yapısı hakkında kendi görüşünü özetledi. İşte bazı noktaları:
- moleküllerdeki atomlar, dış orbitallerindeki elektron sayısına bağlı olarak birbirine bağlanır;
- atomların bağlanma dizisindeki bir değişiklik, molekülün özelliklerinde ve yeni bir maddenin ortaya çıkmasında bir değişikliğe yol açar;
- maddelerin kimyasal ve fiziksel özellikleri sadece hangi atomların bileşimine dahil edildiğine değil, aynı zamanda birbirleriyle bağlantı sıralarına ve karşılıklı etkilere de bağlıdır;
- bir maddenin moleküler ve atomik bileşimini belirlemek için, ardışık dönüşümler zincirinin yürütülmesi gerekir.
Moleküllerin geometrik yapısı

Atom ve moleküllerin kimyasal yapısıüç yıl sonra Butlerov tarafından desteklendi. İzomerizm fenomenini bilime sokar, aynı nitel kompozisyona, ancak farklı bir yapıya sahip olsa bile, maddelerin bir dizi göstergede birbirinden farklı olacağını varsayar.
On yıl sonra, üç boyutlu doktrinmoleküler yapı. Her şey Van Goff'un Kuaterner değerlik sistemi teorisini karbon atomunda yayınlamasıyla başlar. Modern bilim adamları stereokimyanın iki alanını birbirinden ayırır: yapısal ve mekansal.
Buna karşılık, yapısal kısım da ayrılmıştıriskelet ve pozisyonun izomeri. Organik maddeleri incelerken, nitel bileşimleri statik olduğunda ve sadece hidrojen ve karbon atomlarının sayısı ve moleküldeki bileşiklerinin dizisi dinamiklere maruz kaldığında dikkate alınması önemlidir.
Bunlarda mekansal izomerizm gereklidiratomları aynı sırada bulunan, ancak uzayda molekülün farklı olduğu bileşikler olduğu durumlar. Optik izomerizm (stereoizomerler birbirini yansıttığında), diastereomerizm, geometrik izomerizm ve diğerleri ayırt edilir.
Moleküllerde atomlar

Bir molekülün klasik kimyasal yapısıiçindeki bir atomun varlığını ima eder. Bir moleküldeki atomun kendisinin değişebileceği ve özelliklerinin de değişebileceği varsayımsal olarak açıktır. Başka hangi atomların onu çevrelediğine, aralarındaki mesafeye ve molekülün gücünü sağlayan bağlara bağlıdır.
Genel teoriyi uzlaştırmak isteyen modern araştırmacılargörelilik ve kuantum teorisi, başlangıç noktası olarak bir molekül oluştuğunda, bir atomun onu sadece çekirdek ve elektronlarla terk ettiği ve varlığının sona erdiği gerçeğini alır. Tabii ki, bu formülasyon hemen ulaşmadı. Atomun bir molekül birimi olarak korunması için birkaç girişimde bulunuldu, ancak hepsi ayırt edici zihni tatmin edemedi.
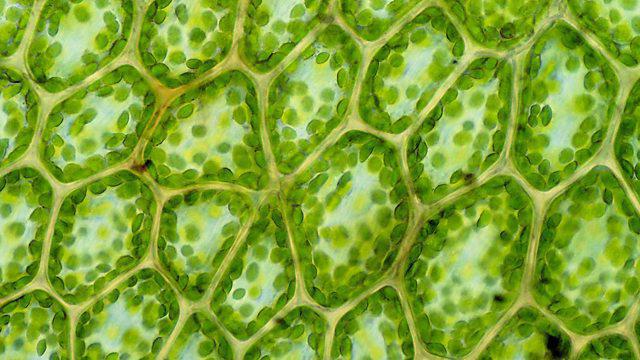
Hücrenin yapısı, kimyasal bileşimi
"Kompozisyon" kavramı, bir hücrenin oluşumunda ve hayati aktivitesinde yer alan tüm maddelerin birleşmesi anlamına gelir. Bu liste, periyodik elementlerin neredeyse tüm tablosunu içerir:
- seksen altı unsur sürekli olarak mevcuttur;
- yirmi beş tanesi normal yaşam için deterministiktir;
- yaklaşık yirmi tane daha kesinlikle gereklidir.
İlk beş kazanan oksijen, içerikle açılırHücredeki her hücrede yüzde yetmiş beşe ulaşır. Suyun ayrışması sırasında oluşur, hücresel solunum reaksiyonları için gereklidir ve diğer kimyasal etkileşimler için enerji sağlar. Bir sonraki önemde karbon. Tüm organik maddelerin temelidir ve aynı zamanda fotosentez için bir substrattır. Bronz, Evrendeki en bol element olan hidrojeni alır. Ayrıca organik bileşiklerde karbona eşit olarak bulunur. Suyun önemli bir bileşenidir. Onurlu dördüncü sırada, amino asitlerin oluşumu için gerekli olan nitrojen ve bunun sonucunda proteinler, enzimler ve hatta vitaminler bulunur.
Hücrenin kimyasal yapısı daha azkalsiyum, fosfor, potasyum, kükürt, klor, sodyum ve magnezyum gibi popüler elementler. Birlikte, hücredeki toplam madde miktarının yaklaşık yüzde birini kaplarlar. Canlı organizmalarda eser miktarlarda bulunan mikro elementler ve ultramikroelementler de ayırt edilir.