Понятие химической связи имеет немаловажное bir bilim olarak kimyadaki çeşitli alanlarda değer. Bunun nedeni, ayrı ayrı atomların moleküller halinde birleşerek, kimyasal araştırma konusu olan her türlü maddeyi oluşturabilmeleridir.
Atom ve molekül çeşitliliği, aralarında çeşitli bağ türlerinin ortaya çıkmasıyla ilişkilidir. Farklı molekül sınıfları, elektron dağılımının kendi özellikleri ve dolayısıyla kendi bağ türleri ile karakterize edilir.
Temel kavramlar
Kimyasal bağ etkileşimler kümesini çağırınatomların daha karmaşık bir yapıya (moleküller, iyonlar, radikaller) ve ayrıca agregalara (kristaller, camlar vb.) Sahip kararlı parçacıkların oluşumu ile bağlanmasına yol açar. Bu etkileşimlerin doğası elektrikseldir ve yaklaşan atomlarda değerlik elektronlarının dağılımı sırasında ortaya çıkarlar.
Değer kabul edildi bir atomun yeteneğini adlandırındiğer atomlarla belirli sayıda bağ oluşturur. İyonik bileşiklerde, bağışlanan veya bağlanan elektronların sayısı değerlik değeri olarak alınır. Kovalent bileşiklerde, ortak elektron çiftlerinin sayısına eşittir.
Altında oksidasyon durumu şartlı olarak anlaşılır tüm polar kovalent bağlar iyonik olsaydı bir atom üzerinde olabilecek yük
İletişimin çokluğu denir dikkate alınan atomlar arasındaki paylaşılan elektron çifti sayısı.
Çeşitli kimya dallarında ele alınan bağlar, iki tür kimyasal bağa ayrılabilir: yeni maddelerin oluşumuna yol açanlar (intramoleküler)ve moleküller arasında ortaya çıkanlar (moleküller arası).
Temel iletişim özellikleri
İletişim enerjisiyle moleküldeki tüm mevcut bağları kırmak için gereken enerjiye denir. Aynı zamanda bir bağ oluşumu sırasında açığa çıkan enerjidir.
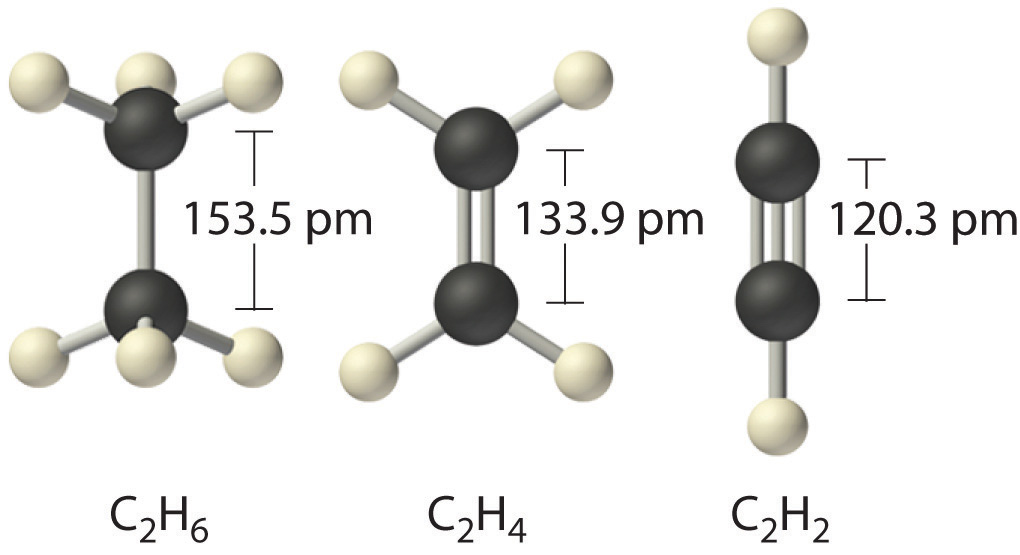
İletişim uzunluğu "Çekme" ve itme kuvvetlerinin dengelendiği bir moleküldeki bitişik atom çekirdekleri arasındaki mesafeyi ifade eder.
Atomların kimyasal bağının bu iki özelliği, gücünün bir ölçüsüdür: uzunluk ne kadar kısa ve enerji ne kadar büyükse, bağ o kadar güçlüdür.
Değerlik açısı atomların çekirdeklerinden bağ yönünde geçen temsil edilen çizgiler arasındaki açıyı çağırmak gelenekseldir.
İlişki açıklama yöntemleri
Kuantum mekaniğinden ödünç alınan kimyasal bağı açıklamaya yönelik en yaygın iki yaklaşım:
Moleküler yörünge yöntemi. Bir molekülü bir yığın olarak görüratomların elektronları ve çekirdekleri ve her bir elektron, diğer tüm elektronların ve çekirdeklerin etki alanında hareket eder. Molekülün yörünge bir yapısı vardır ve tüm elektronları bu yörüngeler boyunca dağılmıştır. Ayrıca, bu yönteme MO LCAO adı verilir ve "moleküler orbital - atomik orbitallerin doğrusal bir kombinasyonu" anlamına gelir.
Değerlik bağları yöntemi. Bir molekülü iki merkezi sistem olarak temsil edermoleküler orbitaller. Dahası, her biri moleküldeki iki bitişik atom arasındaki bir bağa karşılık gelir. Yöntem aşağıdaki hükümlere dayanmaktadır:
- Kimyasal bir bağın oluşumu bir çift tarafından gerçekleştirilir.düşünülen iki atom arasında yer alan zıt dönüşlere sahip elektronlar. Oluşan elektron çifti eşit olarak iki atoma aittir.
- Bir veya başka bir atomun oluşturduğu bağların sayısı, yerdeki ve uyarılmış hallerdeki eşleşmemiş elektronların sayısına eşittir.
- Elektronik çiftler bir bağ oluşumunda yer almazlarsa, bunlara yalnız çiftler denir.
Elektronegatiflik
Bileşen atomlarının elektronegatiflik değerlerindeki farklılığa dayanarak maddelerdeki kimyasal bağın türünü belirlemek mümkündür. Altında elektronegatiflik Atomların, bağın polarizasyonuna yol açan ortak elektron çiftlerini (elektron bulutu) çekme yeteneğini anlar.
Değerleri tanımlamanın çeşitli yolları vardırkimyasal elementlerin elektronegatiflikleri. Bununla birlikte, en çok kullanılan, 1932'de L. Pauling tarafından önerilen termodinamik verilere dayanan ölçektir.

Fark ne kadar büyükseatomların elektronegatifliği, iyonikliği daha fazla ortaya çıkar. Aksine, eşit veya yakın elektronegatiflik değerleri, bağın kovalent yapısını gösterir. Başka bir deyişle, belirli bir molekülde ne tür bir kimyasal bağın gözlendiğini matematiksel olarak belirlemek mümkündür. Bunu yapmak için, ΔХ - atomların elektronegatiflikleri arasındaki farkı aşağıdaki formüle göre hesaplamanız gerekir: ΔX = | X1-X2|.
- Eğer ΔX> 1.7, o zaman bağ iyoniktir.
- Eğer 0.5≤ΔX≤1.7, daha sonra kovalent bağ kutuptur.
- Eğer ΔX = 0 veya ona yakınsa, bağ bir kovalent polar olmayan anlamına gelir.
İyonik bağ
İyonik görünen bir bağlantıdıriyonlar arasında veya ortak bir elektron çiftinin atomlardan biri tarafından tamamen çekilmesi nedeniyle. Maddelerde bu tür kimyasal bağ, elektrostatik çekim kuvvetleri tarafından gerçekleştirilir.
İyonlar, aşağıdakilerden oluşan yüklü parçacıklardırelektronların bağlanması veya salınmasının bir sonucu olarak atomlar. Bir atom elektronları kabul ederse, negatif bir yük alır ve bir anyon haline gelir. Atom değerlik elektronları bağışlarsa, katyon adı verilen pozitif yüklü bir parçacık haline gelir.
Oluşan bileşiklerin karakteristiğidir.tipik metallerin atomlarının tipik metal olmayan atomlarla etkileşimi. Bu sürecin ana kısmı, atomların kararlı elektronik konfigürasyonlar elde etme arzusudur. Ve bunun için tipik metaller ve metal olmayanlar sadece 1-2 elektron vermeli veya almalıdır ki bunu kolayca yaparlar.

İyonik bir kimyasal bağ oluşum mekanizmasımolekül, geleneksel olarak sodyum ve klorin etkileşimi örneğinde kabul edilir. Alkali metal atomları, bir halojen atomunun çektiği bir elektronu kolayca bağışlar. Sonuç olarak, Na katyonu oluşur+ ve anyon Cl-elektrostatik çekim ile bir arada tutulanlar.
İdeal bir iyonik bağ yoktur.Genellikle iyonik olarak adlandırılan bu tür bileşiklerde bile, elektronların atomdan atoma son geçişi gerçekleşmez. Oluşan elektron çifti hala ortak kullanımdadır. Bu nedenle, kovalent bağın iyonlaşma derecesinden söz edilir.
İyonik bağ, birbiriyle ilişkili iki ana özellik ile karakterize edilir:
- yönsüzlük, yani iyonun etrafındaki elektrik alanı bir küre şeklindedir;
- doymamışlık, yani herhangi bir iyonun etrafına yerleştirilebilen zıt yüklü iyonların sayısı, boyutlarına göre belirlenir.
kovalent kimyasal bağ
Elektroniklerin örtüşmesiyle oluşan bağortak bir elektron çifti tarafından gerçekleştirilen metal olmayan atom bulutlarına kovalent bağ denir. Ortak elektron çiftlerinin sayısı bağın çokluğunu belirler. Böylece, hidrojen atomları tek bir H ··· H bağı ile bağlanır ve oksijen atomları bir çift O :: O bağı oluşturur.
Oluşumu için iki mekanizma vardır:
- Değiştirilebilir - her atom temsil ederortak bir elektron çiftinin oluşumu: A + B = A: B, bir elektronun bulunduğu dış atomik orbitaller ise bağın uygulanmasına katılır.
- Verici-alıcı - bir bağ oluşumu için, atomlardan biri (verici) bir çift elektron sağlar ve ikincisi (alıcı) yerleştirilmesi için serbest bir yörünge sağlar: A +: B = A: B.

Kovalent bir kimyasal bağın oluşumu sırasında elektron bulutlarının örtüşme yöntemleri de farklıdır.
- Doğrudan.Bulut örtüşme bölgesi, söz konusu atomların çekirdeklerini birleştiren düz bir hayali çizgi üzerinde yer alır. Bu durumda, σ-bağları oluşur. Bu durumda meydana gelen kimyasal bağın tipi, örtüşen elektron bulutlarının tipine bağlıdır: s-s, s-p, p-p, s-d veya p-d σ-bağları. Bir parçacıkta (molekül veya iyon), iki komşu atom arasında yalnızca bir σ-bağ mümkündür.
- Yanal.Atom çekirdeğini bağlayan hattın her iki tarafında gerçekleştirilir. Bir π bağı bu şekilde oluşur ve çeşitleri de mümkündür: p-p, p-d, d-d. σ-bağı dışında, π-bağı asla oluşmaz, çoklu (ikili ve üçlü) bağ içeren moleküllerde olabilir.
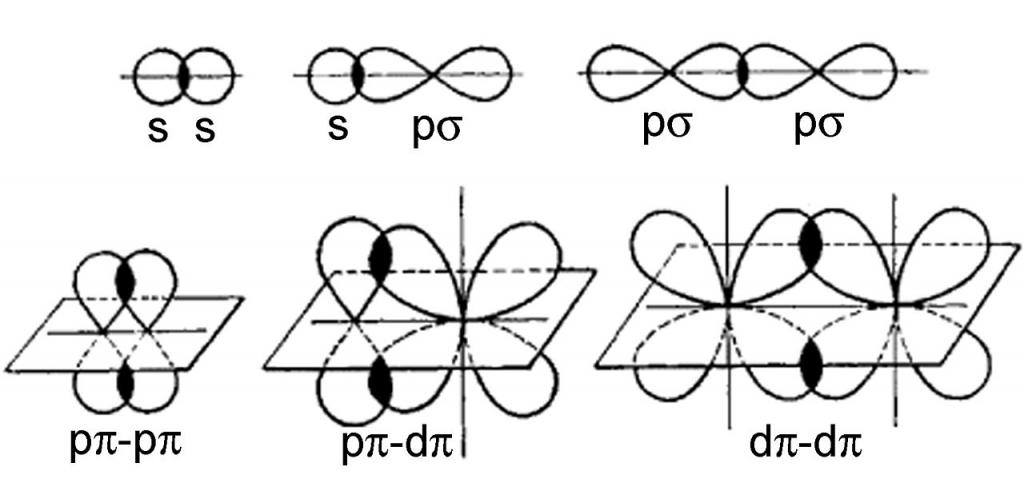
kovalent bağ özellikleri
Kimyasal ve fiziksel durumu belirleyen onlardır.bağlantıların özellikleri. Maddelerdeki herhangi bir kimyasal bağın ana özellikleri, yönlülüğü, polaritesi ve polarize edilebilirliği ile doygunluğudur.
yön bağlantı, molekülerin özelliklerinden kaynaklanmaktadır.maddelerin yapısı ve moleküllerinin geometrik şekli. Özü, elektron bulutlarının en iyi örtüşmesinin uzayda belirli bir yönelimle mümkün olmasıdır. σ- ve π-bağlarının oluşum varyantları yukarıda zaten ele alınmıştır.
Altında doyma Atomların bir molekülde belirli sayıda kimyasal bağ oluşturma yeteneğini anlar. Her atom için kovalent bağ sayısı, dış orbitallerin sayısı ile sınırlıdır.
Polarite bağlantı, değerler arasındaki farka bağlıdıratomların elektronegatiflikleri. Atomların çekirdekleri arasındaki elektron dağılımının tekdüzeliği buna bağlıdır. Bu özellik için bir kovalent bağ, polar veya polar olmayan olabilir.
- Ortak bir elektron çifti, atomların her birine eşit olarak aitse ve çekirdeklerinden aynı uzaklıkta bulunuyorsa, kovalent bağ polar değildir.
- Ortak elektron çifti, atomlardan birinin çekirdeğine yer değiştirirse, kovalent bir polar kimyasal bağ oluşur.
Polarize edilebilirlik altındaki bağ elektronlarının yer değiştirmesi ile ifade edilir.başka bir parçacığa, aynı moleküldeki komşu bağlara ait olabilen veya harici elektromanyetik alan kaynaklarından gelen harici bir elektrik alanının etkisi. Böylece, etkileri altındaki bir kovalent bağ, polaritesini değiştirebilir.
Yörüngelerin hibridizasyonu, kimyasal bağlanma sırasında şekillerinde bir değişiklik anlamına gelir. Bu, en etkili örtüşmeyi elde etmek için gereklidir. Aşağıdaki hibridizasyon türleri vardır:
- sp3... Bir s ve üç p orbitali, aynı şekle sahip dört "melez" orbital oluşturur. Dışa doğru, eksenleri 109 ° 'lik bir açıya sahip bir tetrahedron'u andırıyor.
- sp2... Bir s- ve iki p-orbital, eksenler arasında 120 ° açı ile düz bir üçgen oluşturur.
- sp. Bir s- ve bir p-orbital, eksenleri arasında 180 ° açı olan iki "hibrit" yörünge oluşturur.
metalik bağ
Metal atomlarının yapısının bir özelliği,oldukça büyük yarıçap ve dış yörüngelerde az sayıda elektron varlığı. Sonuç olarak, bu tür kimyasal elementlerde çekirdek ile değerlik elektronları arasındaki bağ nispeten zayıftır ve kolayca kırılır.
Metal bağ, delokalize elektronların yardımıyla gerçekleştirilen metallerin atom-iyonları arasındaki böyle bir etkileşim olarak adlandırılır.
Metal parçacıklarda değerlik elektronlarıdış yörüngeleri terk etmek ve üzerlerinde boş yerleri işgal etmek kolaydır. Böylece, farklı zamanlarda aynı parçacık bir atom ve bir iyon olabilir. Onlardan ayrılan elektronlar, kristal kafesin hacmi boyunca serbestçe hareket eder ve kimyasal bir bağ gerçekleştirir.

Bu bağ türü iyonik vekovalent. İyonik bağa gelince, metalik bir bağın varlığı için iyonlar gereklidir. Ancak ilk durumda elektrostatik etkileşimin uygulanması için katyonlara ve anyonlara ihtiyaç duyulursa, ikincisinde negatif yüklü parçacıkların rolü elektronlar tarafından oynanır. Metalik bir bağı kovalent bir bağla karşılaştırırsak, her ikisinin de oluşumu için ortak elektronlar gerekir. Bununla birlikte, bir polar kimyasal bağdan farklı olarak, iki atom arasında yer almazlar, kristal kafes içindeki tüm metal parçacıklara aittirler.
Hemen hemen tüm metallerin özel özellikleri metal bağından kaynaklanmaktadır:
- plastisite, bir elektron gazı tarafından tutulan kristal kafes içindeki atom katmanlarının yer değiştirme olasılığı nedeniyle mevcuttur;
- ışık ışınlarının elektronlardan yansıması nedeniyle gözlenen metalik parlaklık (toz halinde kristal kafes yoktur ve bu nedenle elektronlar onun üzerinde hareket eder);
- yüklü parçacıkların akışı ile gerçekleştirilen elektriksel iletkenlik ve bu durumda küçük elektronlar büyük metal iyonları arasında serbestçe hareket eder;
- elektronların ısı transfer etme yeteneği nedeniyle gözlenen termal iletkenlik.
Hidrojen bağı
Bu tür kimyasal bağa bazen denir.kovalent ve moleküller arası etkileşimler arasında ara. Bir hidrojen atomu, kuvvetli elektronegatif elementlerden (fosfor, oksijen, klor, azot gibi) biriyle bir bağa sahipse, hidrojen adı verilen ek bir bağ oluşturabilir.
Yukarıda sayılan tüm bağ türlerinden çok daha zayıftır (enerji 40 kJ / mol'ü aşmaz), ancak ihmal edilemez. Bu nedenle diyagramdaki hidrojen kimyasal bağı noktalı bir çizgi gibi görünmektedir.

Bir hidrojen bağı oluşumu nedeniyle mümkündürverici-alıcı elektrostatik etkileşimi aynı anda. Elektronegatiflik değerlerinde büyük bir fark, O, N, F ve diğerlerinin atomlarında aşırı elektron yoğunluğunun ortaya çıkmasına ve ayrıca hidrojen atomundaki eksikliğine yol açar. Bu tür atomlar arasında herhangi bir kimyasal bağ olmaması durumunda, yeterince yakın olduklarında çekim kuvvetleri harekete geçer. Bu durumda proton elektron çiftinin alıcısı, ikinci atom ise vericidir.
Hem bitişik moleküller, örneğin su, karboksilik asitler, alkoller, amonyak arasında hem de bir molekül içinde, örneğin salisilik asit arasında bir hidrojen bağı oluşabilir.
Su molekülleri arasında bir hidrojen bağının varlığı, suyun bir dizi benzersiz fiziksel özelliğini açıklar:
- Isı kapasitesinin değerleri, dielektrikgeçirgenlik, kaynama ve erime noktaları, hesaplamalara göre, moleküllerin bağlanabilirliği ve moleküller arası hidrojen bağlarını kırmak için enerji harcama ihtiyacı ile açıklanan gerçeklerden önemli ölçüde düşük olmalıdır.
- Diğer maddelerden farklı olarak, indirirkensıcaklık, suyun hacmi artar. Bunun nedeni, moleküllerin buzun kristal yapısında belirli bir pozisyonda yer almaları ve hidrojen bağı uzunluğu kadar birbirlerinden uzaklaşmalarıdır.
Bu bağlantı yaşayanlar için özel bir rol oynar.organizmalar, çünkü protein moleküllerindeki varlığı onların özel yapılarını ve dolayısıyla özelliklerini belirler. Ek olarak, DNA'nın çift sarmalını oluşturan nükleik asitler de hidrojen bağlarıyla bağlanır.
kristal bağlar
Katıların büyük çoğunluğununkristal kafes - onları oluşturan parçacıkların özel bir karşılıklı düzenlemesi. Bu durumda, üç boyutlu bir periyodiklik gözlenir ve hayali çizgilerle birbirine bağlanan düğümlerde atomlar, moleküller veya iyonlar bulunur. Bu parçacıkların doğasına ve aralarındaki bağlara bağlı olarak tüm kristal yapılar atomik, moleküler, iyonik ve metalik olarak ayrılır.
İyonik kristal kafesin yerlerikatyonlar ve anyonlar. Ayrıca, her biri, yalnızca zıt yüklere sahip, kesin olarak tanımlanmış sayıda iyonla çevrilidir. Tipik bir örnek sodyum klorürdür (NaCl). Kırılmaları için çok fazla enerjiye ihtiyaç duydukları için yüksek erime noktalarına ve sertliğe sahip olma eğilimindedirler.
Moleküler kristal kafesin bölgelerinde, bir kovalent bağ tarafından oluşturulan maddelerin molekülleri bulunur (örneğin, I2). Zayıf bir van der Waals etkileşimi ile birbirlerine bağlanırlar ve bu nedenle böyle bir yapının yok edilmesi kolaydır. Bu tür bileşikler düşük kaynama ve erime noktalarına sahiptir.
Atomik kristal kafes atomlardan oluşuryüksek değerlik değerlerine sahip kimyasal elementler. Güçlü kovalent bağlarla bağlanırlar, bu da maddelerin yüksek kaynama noktalarına, erime noktalarına ve büyük sertliğe sahip olduğu anlamına gelir. Bir örnek bir elmastır.
Böylece, mevcut tüm bağlantı türlerikimyasalların, moleküller ve maddelerdeki parçacıkların etkileşiminin inceliklerini açıklayan kendi özellikleri vardır. Bağlantıların özellikleri bunlara bağlıdır. Çevrede meydana gelen tüm süreçleri belirlerler.








