İkili bileşikler, iki farklı kimyasal elementin oluşturduğu maddelerdir. Bu terim, inorganik bileşiklerin kalitatif ve kantitatif bileşimini belirtmek için kullanılır.
İkili kimyasal bileşikler önemli kabul edilirMaddelerin doğası çalışmasında nesne. Bunları açıklarken şu kavramlar kullanılır: bağ polarizasyonu, oksidasyon durumu, değerlik. Bu kimyasal terimler, bir kimyasal bağ oluşumunun özünü, inorganik maddelerin yapısal özelliklerini anlamayı mümkün kılar.
İkili bileşiklerin ana sınıflarını, kimyasal yapılarının ve özelliklerinin özelliklerini ve endüstriyel uygulamalarının bazı alanlarını ele alalım.

Oksitler
Bu inorganik madde sınıfı, doğada en yaygın olanıdır. Bu bileşik grubunun bilinen temsilcileri arasında şunları vurguluyoruz:
- silikon oksit (nehir kumu);
- hidrojen oksit (su);
- karbon dioksit;
- kil (alüminyum oksit);
- demir cevheri (demir oksitler).
Bu tür ikili bileşikler, zorunlu olarak oksijen içeren ve -2 oksidasyon durumu sergileyen karmaşık maddelerdir.
Toplam oksit durumu
Bakır, kalsiyum, demir bileşiklerikristalin katılar. Bazı metal olmayan oksitler, örneğin altı değerlikli kükürt, beş değerli fosfor, silikon gibi aynı toplanma durumuna sahiptir. Su, normal koşullar altında bir sıvıdır. Metal olmayan oksijen bileşiklerinin büyük çoğunluğu gazlardır.
Eğitimin özellikleri
Birçok ikili oksijen bileşiği oluşurdoğada. Örneğin yakıtın yanması, nefes alması, organik maddenin çürümesi sırasında karbondioksit (karbon monoksit 4) oluşur. Havada hacimsel içeriği yaklaşık yüzde 0,03'tür.
Benzer ikili bileşikler ürünlerdirvolkanların aktivitesi ve maden suyunun ayrılmaz bir parçası. Karbondioksit yanmayı desteklemez, bu nedenle bu kimyasal bileşik yangınları söndürmek için kullanılır.
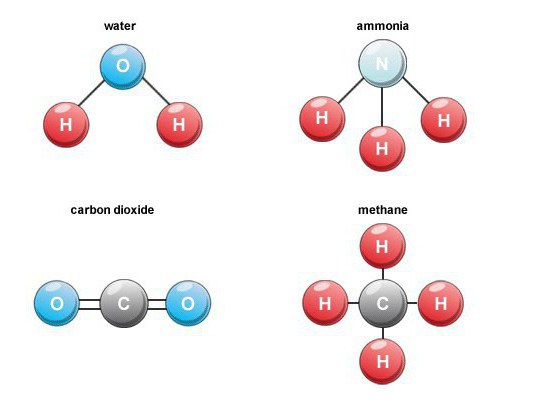
Uçucu hidrojen bileşikleri
Bu tür ikili bileşikler önemli bir gruptur.hidrojen içeren maddeler. Endüstriyel öneme sahip temsilciler arasında metan, su, hidrojen sülfür, amonyak ve ayrıca hidrojen halojenürleri not ediyoruz.
Bazı uçucu hidrojen bileşikleri toprak sularında ve canlı organizmalarda bulunur, bu nedenle bunların jeokimyasal ve biyokimyasal rollerinden bahsedebiliriz.
Bu tipteki ikili bileşikleri oluşturmak için, ilk sırada bir valansa sahip olan hidrojen konur. İkinci element, negatif oksidasyon durumuna sahip metal olmayan bir elementtir.
İkili birleşimde indisleri düzenlemek içinen küçük ortak kat, değerler arasında belirlenir. Her elementin atom sayısı, bileşiğin parçası olan her elementin değerine bölünerek belirlenir.

Hidrojen klorür
İkili bileşiklerin formüllerini düşünün:hidrojen klorür ve amonyak. Modern kimya endüstrisi için önemli olan bu maddelerdir. Normal koşullar altında HCl, suda oldukça çözünür olan gaz halindeki bir bileşiktir. Hidrojen klorür gazı çözüldükten sonra birçok kimyasal işlemde ve endüstriyel zincirlerde kullanılan hidroklorik asit oluşur.
Bu ikili bileşik, insanların ve hayvanların mide suyunda bulunur, mideye yiyecekle nüfuz eden patojenik mikroplar için bir engeldir.
Hidroklorik asidin ana uygulama alanları arasında, klorür üretimi, klor içeren ürünlerin sentezi, metallerin aşındırılması, oksit ve karbonatlardan boruların temizlenmesi ve deri üretimini ön plana çıkarıyoruz.
NH formülüne sahip amonyak3renksiz bir gazdırbelirli keskin koku. Suda sınırsız çözünürlüğü, tıpta talep gören amonyak elde etmeyi mümkün kılar. Doğada, bu ikili bileşik, nitrojen içeren organik ürünlerin çürümesi sırasında oluşur.

Oksit sınıflandırması
Değerliği 1 veya 2 olan bir metalin oksijen içeren ikili bileşiği, bazik oksittir. Örneğin, bu grup alkali ve alkali toprak metal oksitlerini içerir.
Metal olmayan oksitlerin yanı sıra değeri 4'ten fazla olan metaller asidik bileşiklerdir.
Kimyasal özelliklere bağlı olarak, bu sınıfın temsilcileri tuz oluşturan ve tuz oluşturmayan gruplara ayrılır.
İkinci grubun tipik temsilcileri arasında karbon monoksit (CO), nitrojen oksit 1 (NO) not ediyoruz.
Bileşiklerin sistematik adlarının oluşumu
Başarılı olan mezunlara sunulan görevler arasındakimyada devlet sınavı, şu da var: "Kükürtün olası ikili oksijen bileşiklerinin (nitrojen, fosfor) moleküler formüllerini oluşturun." Eldeki görevle baş edebilmek için, sadece algoritma hakkında değil, aynı zamanda bu inorganik madde sınıfının isimlendirmesinin özellikleri hakkında da bir fikir sahibi olmak gerekir.
İkili ismini oluştururkenbileşikler, başlangıçta formülün sağında bulunan öğeyi belirtir ve "id" sonekini ekler. Ardından, ilk elemanın adını belirtin. Kovalent bileşikler için, bir ikili bileşiğin kurucu kısımları arasında niceliksel bir oran oluşturabileceğiniz önekler eklenir.
Örneğin SO3 - kükürt trioksit, N2aman4 - dinitrojen tetroksit, I2CL6 - diyot heksaklorür.
Farklı oksidasyon durumları sergileyebilen ikili bir bileşikte bir kimyasal element mevcutsa, oksidasyon durumu, bileşiğin adından sonra parantez içinde belirtilir.
Örneğin, iki demir bileşiği isim olarak farklılık gösterir: FeCL3 - demir oksit (3), FeCL2 - demir oksit (2).
Hidritler için, özellikle metalik olmayan elementler için önemsiz isimler kullanırlar. Yani, H2O - su, HCL - hidrojen klorür, HI - hidrojen iyodür, HF - hidroflorik asit.

Katyonlar
Bu elementlerin pozitif iyonlarısadece bir kararlı iyon oluşturabilen, sembollerin kendileriyle aynı isimleri vermelidir. Bunlar, Mendeleev'in periyodik sisteminin birinci ve ikinci gruplarının tüm temsilcilerini içerir.
Örneğin, sodyum ve magnezyum katyonları şu şekildedir: Na+, Mg2+... Geçiş unsurları birkaç tür katyon oluşturabilir, bu nedenle ad, her bir durumda ortaya çıkan değeri göstermelidir.
Anyonlar
Basit (tek atomlu) ve karmaşık (çok atomlu) anyonlar için –id soneki kullanılır.
Belirli bir kişinin yaygın bir oksoanionuöğe -am sonekidir. Formüldeki daha düşük oksidasyon durumuna sahip bir elementin oksoanyonu için –it soneki kullanılır. Minimum yükseltgenme durumu için ön ek hipo kullanılır ve maksimum değer için önek kullanılır. Örneğin, iyon O2- bir oksit iyonudur ve O- - peroksit.
Hidritler için çeşitli önemsiz isimler de vardır. Örneğin, N2X4 hidrazin ve PH olarak adlandırılır3 fosfin denir.
Sülfür içeren oksoanyonlar aşağıdaki isimlere sahiptir:
- CO42- - sülfat;
- C2aman32- - tiyosülfat;
- NCS- - tiyosiyanat.
Tuz
Pek çok kimya final testi öneriyorsonraki görev: "İkili metal bileşiklerinin formüllerini oluşturun." Bu tür bileşikler klor, brom, iyot anyonları içeriyorsa, bu tür bileşikler halojenürler olarak adlandırılır ve tuzlar sınıfına aittir. Bu ikili bileşiklerin formüllerini çizerken önce metal, ardından karşılık gelen halojenür iyonu yerleştirilir.
Her bir elementin atom sayısını belirlemek için, değerler arasındaki en küçük kat bulunur ve bölünürken endeksler elde edilir.
Bu bileşiklerin erime noktası yüksekve kaynama, suda iyi çözünürlük, normal koşullar altında katılardır. Örneğin, deniz suyunda sodyum ve potasyum klorürler bulunur.
İnsanlar eski zamanlardan beri sofra tuzu kullanıyorlar.Şu anda, bu ikili bileşiğin kullanımı gıda tüketimiyle sınırlı değildir. Sulu bir sodyum klorür çözeltisinin elektrolizi, metalik sodyum ve klor gazı üretir. Bu ürünler, örneğin sodyum hidroksit, hidrojen klorür üretimi gibi çeşitli endüstriyel işlemlerde kullanılmaktadır.
İkili bileşiklerin anlamı
Bu grup çok sayıda içerirmaddeler, bu nedenle, insan faaliyetinin çeşitli alanlarında kullanımlarının ölçeği hakkında güvenle konuşabiliriz. Kimya endüstrisindeki amonyak, nitrik asit üretiminde, mineral gübre üretiminde öncü olarak kullanılır. İnce organik sentezde kullanılan ve soğutma ünitelerinde uzun süredir kullanılan bu ikili bileşiktir.
Tungsten karbürün benzersiz sertliği nedeniyle,bu bileşik, çeşitli kesici aletlerin imalatında uygulama alanı bulmuştur. Bu ikili bileşiğin kimyasal inertliği, agresif ortamlarda kullanılmasına izin verir: laboratuvar ekipmanı, fırınlar.
Tıpta genel anestezi için oksijenle karıştırılmış gülme gazı (nitrik oksit 1) kullanılır.
Tüm ikili bileşikler, kovalent veya iyonik bir kimyasal bağa, moleküler, iyonik veya atomik kristal kafese sahiptir.

Sonuç
İkili bileşikler için formüller hazırlarkenbelirli bir dizi eylemi takip etmek gerekir. İlk olarak, pozitif bir oksidasyon durumu sergileyen (daha düşük bir elektriksel negatiflik değerine sahip olan) element kaydedilir. İkinci elemanın oksidasyon durumunun değerini belirlerken, bulunduğu grup numarası sekizden çıkarılır. Elde edilen sayılar birbirinden farklıysa, en küçük ortak kat belirlenir, ardından endeksler hesaplanır.
Oksitlere ek olarak, bu bileşikler şunları içerir:karbürler, silisitler, peroksitler, hidritler. Metan ve asetilenin laboratuar üretimi için alüminyum ve kalsiyum karbürler kullanılır; peroksitler kimya endüstrisinde güçlü oksidanlar olarak kullanılır.
Hidrojen florür gibi bir halojenür (hidroflorikasit), elektrik mühendisliğinde lehimleme için kullanılır. Canlı organizmaların varlığını hayal etmenin zor olduğu en önemli ikili bileşikler arasında su başı çekiyor. Bu inorganik bileşiğin yapısal özellikleri okul kimyası dersinde ayrıntılı olarak incelenmiştir. Onun örneğinde, ikili bileşikler için formüller hazırlarken, adamların eylemlerin sırası hakkında bir fikir edindikleri görülmektedir.
Sonuç olarak, çeşitli ikili bileşiklerin kullanıldığı her yerde böyle bir modern endüstri alanı, insan yaşamının bir alanı bulmanın zor olduğunu not ediyoruz.