Metanul și omologii săi sunt numiți limită(saturate) hidrocarburi parafinice sau alcani. Acest ultim nume este dat substanțelor organice (au formula chimică generală CnH2n + 2, care reflectă saturația moleculelor în care atomii sunt conectați prin legături covalente simple de carbon - hidrogen sau carbon - carbon), atribuite în conformitate cu nomenclatura internațională a compușilor chimici. Au două surse principale: țiței și gaz natural. Proprietățile alcanilor dintr-o serie omologă cu o creștere a numărului de atomi de carbon într-o moleculă se schimbă în mod natural.
Primii patru reprezentanți ai seriei omologeau nume istorice. Hidrocarburile din spatele lor sunt desemnate prin cifre grecești cu sfârșitul –an. Greutatea moleculară relativă a fiecărei hidrocarburi ulterioare diferă de cea anterioară cu 14 amu Proprietățile fizice ale alcanilor, cum ar fi punctul de topire (solidificare) și punctul de fierbere (condens), densitatea și indicele de refracție, cresc odată cu creșterea greutății moleculare. De la metan la butan, acestea sunt gaze, de la pentan la pentadecan, lichide, urmate de solide. Toate parafinele sunt mai ușoare decât apa și nu se dizolvă în ea. Alcanele includ:
- CH4 este metan;
- C2H6 este etan;
- C3H8 - propan;
- C4H10 - Butan;
- Pentan C5H12;
- Hexan C6H14;
- C7H16 - heptan;
- C8H18 este octan;
- C9H20 - nonan;
- C10H22 - decan;
- C11H24 - nedecan;
- C12H26 - Dodecan;
- C13H28 - Tridecane;
- C14H30 - tetradecan;
- C15H32 - Pentadecan;
- C16H34 - hexadecan;
- C17H36 - heptadecan;
- C18H38 - Octadecane;
- C19H40 - nonadecan;
- C20H42 - eicosan și așa mai departe.
Химические свойства алканов отличаются низкой activitate. Acest lucru se datorează rezistenței relative a legăturilor nepolare C-C și a legăturilor C-H nepolare, precum și saturației moleculelor. Toți atomii sunt conectați prin legături σ unice, care sunt greu de rupt din cauza polarizabilității lor scăzute. Ruperea lor poate avea loc numai în anumite condiții, în timp ce se formează radicali care poartă numele compușilor parafină corespunzători cu un capăt de înlocuire. De exemplu, propan-propil (C3H7-), etan-etil (C2H5-), metan-metil (CH3-), etc.
Proprietățile chimice ale alcanilor indică inerțieacești compuși. Nu sunt capabili de reacții de adăugare. Tipic pentru ei sunt reacțiile de substituție. Oxidarea (arderea) hidrocarburilor de parafină are loc numai la temperaturi ridicate. Pot fi oxidate la alcooli, aldehide și acizi. Ca urmare a fisurii (procesul de descompunere termică a hidrocarburilor) al alcanilor mai mari la o temperatură de 450 până la 550 ° C, se pot forma hidrocarburi saturate cu o greutate moleculară mai mică. Odată cu creșterea temperaturii, descompunerea termică se numește piroliză.
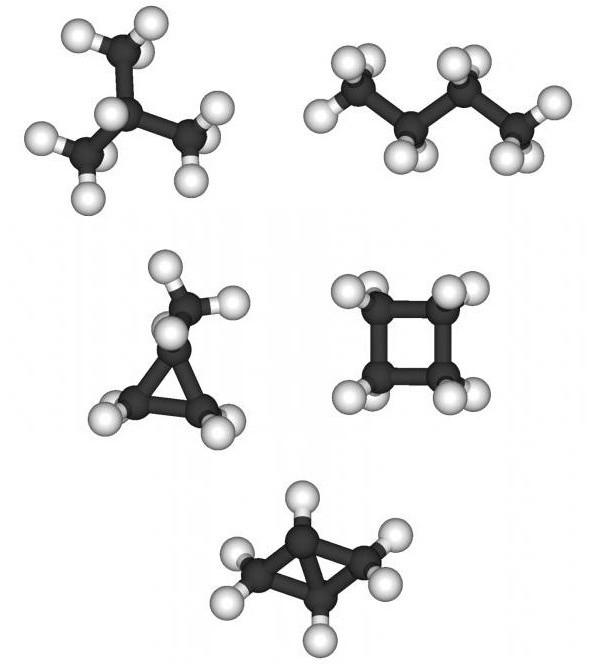
Proprietățile chimice ale alcanilor depind nu numai denumere în molecula atomilor de carbon, dar și din structură. Toate parafinele pot fi separate normal (fiecare atom de C poate fi conectat la nu mai mult de doi atomi de carbon) și structura iso (atomul C poate fi conectat la alți patru atomi de C, datorită acestui fapt molecula are o structură spațială). De exemplu, pentanul și 2,2-dimetilpropanul au aceeași greutate moleculară și aceeași formulă chimică C5H12, dar vor diferi în ceea ce privește proprietățile chimice și fizice: punctul de topire minus 129,7 ° С și minus 16,6 ° С, punctul de fierbere 36,1 ° С și respectiv 9,5 ° C. Izomerii intră mai ușor în reacții chimice decât hidrocarburile cu structură normală cu același număr de atomi de C.
Proprietățile chimice caracteristice ale alcanilor suntreacții de substituție, care includ halogenarea sau sulfonarea. Ca urmare a interacțiunii cu parafinul clor printr-un mecanism radical sub influența temperaturii sau a luminii, se formează derivați de clor metan: clorometan CH3Cl, diclorometan CH2Cl2, triclorometan CHCl3 și tetraclorură de carbon CCl4. Sulfarea alcanilor prin lumina UV are ca rezultat cloruri de sulfonil: R - H + SO2 + Cl2 → R - SO2 - Cl + HCl. Aceste substanțe sunt utilizate la fabricarea agenților tensioactivi.