सबसे सरल कार्बनिक यौगिक संतृप्त और असंतृप्त हाइड्रोकार्बन हैं। इनमें एल्केन्स, एल्केनीज, एल्केनेस के वर्ग के पदार्थ शामिल हैं।
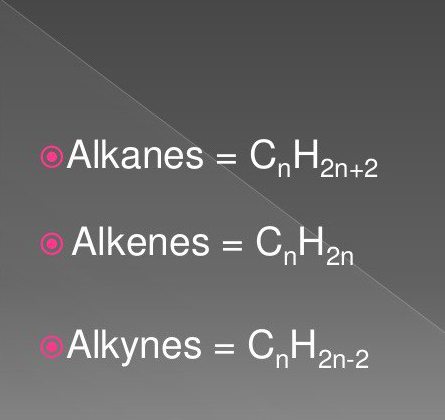
उनके सूत्रों में एक निश्चित अनुक्रम और मात्रा में हाइड्रोजन और कार्बन परमाणु शामिल हैं। वे प्रकृति में आम हैं।
अल्केन्स का निर्धारण
उनका अन्य नाम ओलेफिन या एथिलीन हाइड्रोकार्बन है। यौगिकों के इस वर्ग को 18 वीं शताब्दी में कहा गया था जब तेल तरल - एथिलीन क्लोराइड - की खोज की गई थी।
Alkenes में शामिल पदार्थ होते हैंहाइड्रोजन और कार्बन तत्व। उन्हें एसाइक्लिक हाइड्रोकार्बन के रूप में वर्गीकृत किया गया है। उनके अणु में, एक एकल डबल (असंतृप्त) बंधन होता है जो दो कार्बन परमाणुओं को एक दूसरे से जोड़ता है।
सूत्र सूत्र
यौगिकों के प्रत्येक वर्ग का अपना रासायनिक पदनाम है। उनमें, आवधिक प्रणाली के तत्वों के प्रतीक प्रत्येक पदार्थ के बंधन की संरचना और संरचना को इंगित करते हैं।

Alkenes के लिए सामान्य सूत्र निम्नानुसार है: Cnएक्स2n, जहां संख्या n 2 से अधिक या बराबर है। जब इसे डिक्रिप्ट करते हैं, तो यह देखा जा सकता है कि प्रत्येक कार्बन परमाणु के लिए दो हाइड्रोजन परमाणु हैं।
समरूप संरचनाओं के आणविक सूत्र निम्नलिखित संरचनाओं द्वारा दर्शाए गए हैं: सी2एक्स4, सी3एक्स6, से4एक्स8, सी5एक्स10, सी6एक्स12, सी7एक्स14, सी8एक्स16, सी9एक्स18, सी10एक्स20... यह देखा जा सकता है कि प्रत्येक बाद के हाइड्रोकार्बन में एक और अधिक कार्बन और 2 अधिक हाइड्रोजन होते हैं।
एक अणु में परमाणुओं के बीच रासायनिक यौगिकों के स्थान और क्रम का एक ग्राफिक पदनाम है, जो अल्केन्स के संरचनात्मक सूत्र को दर्शाता है। वैलेंस डैश की मदद से, कार्बन और हाइड्रोजन्स के बीच के बंधन का संकेत मिलता है।
अल्केन्स के संरचनात्मक सूत्र को चित्रित किया जा सकता हैविस्तारित रूप में, जब सभी रासायनिक तत्व और बांड दिखाए जाते हैं। ओलेफिन के लिए अधिक संक्षिप्त अभिव्यक्ति वैलेंस डैश का उपयोग करके कार्बन और हाइड्रोजन के यौगिक को नहीं दिखाती है।
कंकाल सूत्र सरलतम संरचना को दर्शाता है। टूटी हुई रेखा अणु के आधार का प्रतिनिधित्व करती है, जिसमें कार्बन परमाणुओं को उसके सबसे ऊपर और छोर से दर्शाया जाता है, और लिंक हाइड्रोजन का संकेत देते हैं।
ओलेफिन नाम कैसे बनते हैं
व्यवस्थित नामकरण के आधार पर, सूत्रअल्केन्स और उनके नाम संतृप्त हाइड्रोकार्बन से संबंधित अल्केन्स की संरचना से बने हैं। ऐसा करने के लिए, उत्तरार्द्ध के नाम पर, प्रत्यय -an को -en या -en द्वारा प्रतिस्थापित किया जाता है। एक उदाहरण ब्यूटेन से ब्यूटाइलीन का निर्माण और पेंटेन से पेन्टीन है।
कार्बन परमाणुओं के सापेक्ष एक दोहरे बंधन की स्थिति को इंगित करने के लिए, नाम के अंत में एक अरबी अंक इंगित करें।
अल्केन्स का नाम संकेतन पर आधारित हैसबसे लंबी श्रृंखला हाइड्रोकार्बन जिसमें एक दोहरा बंधन मौजूद है। चेन नंबरिंग की शुरुआत के लिए, कार्बन परमाणुओं के असंतृप्त यौगिक के सबसे करीब का अंत आमतौर पर चुना जाता है।
यदि अल्केन्स का संरचनात्मक सूत्र हैशाखाएं, फिर रेडिकल के नाम और उनकी संख्या को इंगित करती हैं, और उनके सामने वे कार्बन श्रृंखला में जगह के अनुरूप संख्या डालती हैं। इसके बाद हाइड्रोकार्बन का नाम आता है। संख्या आमतौर पर एक हाइफ़न द्वारा पीछा की जाती है।
असंतृप्त कट्टरपंथी शाखाएँ हैं। उनके नाम तुच्छ हो सकते हैं या व्यवस्थित नामकरण के नियमों के अनुसार बनते हैं।
उदाहरण के लिए, HNC = CH- को एथेनिल या विनाइल के रूप में जाना जाता है।
आइसोमरों
Alkenes के आणविक सूत्र isomerism का संकेत नहीं दे सकते हैं। हालांकि, पदार्थों के इस वर्ग के लिए, एथिलीन अणु के अपवाद के साथ, स्थानिक संशोधन अंतर्निहित है।

इथाइलीन हाइड्रोकार्बन के आइसोमर्स कार्बन कंकाल, असंतृप्त बंध स्थिति, इंटरक्लास या स्थानिक हो सकते हैं।
Alkenes का सामान्य सूत्र राशि निर्धारित करता हैश्रृंखला में कार्बन और हाइड्रोजन परमाणु, लेकिन यह दोहरे बंधन की उपस्थिति और स्थान नहीं दिखाता है। एक उदाहरण C के इंटरक्लास आइसोमर के रूप में साइक्लोप्रोपेन है3एक्स6 (प्रोपलीन)। सी में अन्य प्रकार के आइसोमेरिज्म दिखाई देते हैं4एक्स8 या ब्यूटेन।
असंतृप्त कनेक्शन की एक अलग स्थिति देखी जाती हैब्यूटेन -1 या ब्यूटेन -2, पहले मामले में डबल यौगिक पहले कार्बन परमाणु के पास स्थित है, और दूसरे में - श्रृंखला के बीच में। कार्बन कंकाल आइसोमेरिज़म को मिथाइलप्रोपीन (सीएच) का उपयोग करके माना जा सकता है3-सी (सीएच)3) = सीएच2) और आइसोब्यूटिलीन (सीएच)3) 2 सी = सीएच2)।
स्थानिक संशोधन ब्यूटेन -2 में निहित हैट्रांस और सीआईएस स्थिति। पहले मामले में, साइड रेडिकल्स एक डबल बॉन्ड के साथ मुख्य कार्बन श्रृंखला के ऊपर और नीचे स्थित हैं, दूसरे आइसोमर में, सब्स्टीट्यूट्स एक तरफ हैं।
ओलेफिन की विशेषता
अल्केन्स का सामान्य सूत्र इस वर्ग के सभी प्रतिनिधियों की शारीरिक स्थिति को निर्धारित करता है। एथिलीन से शुरू होता है और ब्यूटिलीन से समाप्त होता है (सी से2 से सी4), पदार्थ गैसीय रूप में मौजूद हैं। तो, रंगहीन एथिन में एक मीठी गंध होती है, पानी में कम घुलनशीलता होती है, और इसका आणविक भार हवा की तुलना में कम होता है।
तरल रूप में, सी से सजातीय अंतराल के हाइड्रोकार्बन5 से सी17... एल्केन के साथ शुरू होता है, जिसमें मुख्य श्रृंखला में 18 कार्बन परमाणु होते हैं, ठोस अवस्था में भौतिक अवस्था का संक्रमण होता है।
सभी ओलेफिन में खराब घुलनशीलता माना जाता हैपानी का वातावरण, लेकिन कार्बनिक सॉल्वैंट्स में अच्छा है, जैसे बेंजीन या गैसोलीन। उनका आणविक भार पानी की तुलना में कम है। कार्बन श्रृंखला में वृद्धि से इन यौगिकों के पिघलने और उबलने के दौरान तापमान संकेतकों में वृद्धि होती है।
ओलेफिन गुण
अल्केन्स के संरचनात्मक सूत्र में उपस्थिति को दर्शाता हैदो कार्बन परमाणुओं के e- और compounds- यौगिकों के दोहरे बंधन का कंकाल। अणु की यह संरचना इसके रासायनिक गुणों को निर्धारित करती है। The-बांड को बहुत मजबूत नहीं माना जाता है, जो दो नए σ-बॉन्ड के गठन के साथ इसे नष्ट करना संभव बनाता है, जो कि परमाणुओं की एक जोड़ी के लगाव के परिणामस्वरूप प्राप्त होते हैं। असंतृप्त हाइड्रोकार्बन इलेक्ट्रॉनिक दाता हैं। वे इलेक्ट्रोफिलिक लगाव प्रक्रियाओं में भाग लेते हैं।
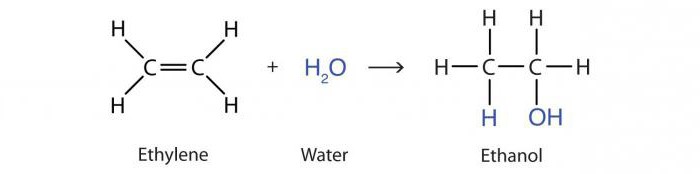
सभी अल्केनों की एक महत्वपूर्ण रासायनिक संपत्ति हैडायह्लोजेनेटेड पदार्थों जैसे यौगिकों की रिहाई के साथ एक हलोजन प्रक्रिया। हैलोजन परमाणु, कार्बन के लिए डबल बॉन्डिंग में सक्षम हैं। एक उदाहरण 1,2-डिब्रोमोप्रोपेन बनाने के लिए प्रोपलीन का ब्रोमिनेशन है:
एक्स2सी = सीएच - सीएच3 + Br2 → BrCH2-CHBr - सीएच3.
अल्केन्स के साथ ब्रोमीन के पानी में रंग को बेअसर करने की इस प्रक्रिया को एक दोहरे बंधन की उपस्थिति का गुणात्मक प्रमाण माना जाता है।
महत्वपूर्ण प्रतिक्रियाओं में ऑलिफिन्स का हाइड्रोजनीकरण शामिल हैप्लैटिनम, पैलेडियम या निकल जैसे उत्प्रेरक धातुओं की कार्रवाई के तहत एक हाइड्रोजन अणु के अतिरिक्त के साथ। परिणाम एक संतृप्त बंधन के साथ हाइड्रोकार्बन है। एल्केन और एल्केन्स के सूत्र ब्यूटेन हाइड्रोजनीकरण प्रतिक्रिया में नीचे दिए गए हैं:
बी3-ch2-सीएच = सीएच2 + एच2 नी→ सीएच3-ch2-ch2-ch3.
ओलेफिन को हाइड्रोजन हलाइड अणु संलग्न करने की प्रक्रिया को कहा जाता है
जलयोजन, नियम के अनुसार गुजरना,मार्कोवनिकोव द्वारा खोजा गया। 2-ब्रोमोप्रोपेन बनाने के लिए एक उदाहरण प्रोपलीन का हाइड्रोब्रोमिनेशन है। इसमें कार्बन के साथ हाइड्रोजन एक दोहरे बंधन के साथ जुड़ता है, जिसे सबसे अधिक हाइड्रोजनीकृत माना जाता है:
बी3-सीएच = सीएच2 + HBr → CH3-ब्रांच - सीएच3.
एसिड की कार्रवाई के तहत अल्केन्स द्वारा पानी को जोड़ने की प्रतिक्रिया को जलयोजन कहा जाता है। परिणाम एक प्रोपेनोल -2 अल्कोहल अणु है:
बी3-एचसी = सीएच2 + एच2ओ → सीएच3-ओएचसीएच - सीएच3.
जब सल्फ्यूरिक एसिड के संपर्क में आते हैं, तो सल्फोनेशन प्रक्रिया होती है:
बी3-एचसी = सीएच2 + हो - ओएसओ - ओह → सीएच3-ch3सीएच - ओ - एसओ2-OH।
प्रतिक्रिया अम्लीय एस्टर के गठन के साथ होती है, उदाहरण के लिए, इसोप्रोपाइलसल्फ़्यूरिक एसिड।
पानी और कार्बन डाइऑक्साइड गैस के गठन के साथ ऑक्सीजन की कार्रवाई के तहत उनके जलने के दौरान क्षार ऑक्सीकरण के अधीन हैं:
2CH3-एचसी = सीएच2 + 9 ओ2 → 6CO2 + 6 एच2ओ
ओलेफिनिक यौगिकों की बातचीत औरसमाधान के रूप में पतला पोटेशियम परमैंगनेट ग्लाइकोल या डायटोमिक अल्कोहल के गठन की ओर जाता है। यह प्रतिक्रिया एथिलीन ग्लाइकॉल और समाधान मलिनकिरण के गठन के साथ ऑक्सीडेटिव भी है:
3 ज2सी = सीएच2 + 4 एच2ओ + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH।
Alkenes के अणु एक मुक्त कण या cation-anionic तंत्र के साथ बहुलकीकरण प्रक्रिया में शामिल हो सकते हैं। पहले मामले में, पेरोक्साइड के प्रभाव के तहत, पॉलीइथिलीन प्रकार का एक बहुलक प्राप्त किया जाता है।
दूसरे तंत्र के अनुसार, एसिड cationic उत्प्रेरक के रूप में कार्य करते हैं, और organometallic पदार्थ एक stereoselective बहुलक की रिहाई के साथ anionic हैं।
अल्कान्स क्या हैं
उन्हें पैराफिन या लिमिटिंग भी कहा जाता हैएसाइक्लिक हाइड्रोकार्बन। उनके पास एक रैखिक या शाखित संरचना है, जिसमें केवल संतृप्त सरल बंधन होते हैं। इस वर्ग की सजातीय श्रृंखला के सभी प्रतिनिधियों के पास सामान्य सूत्र सी हैnएक्स२ एन + २.
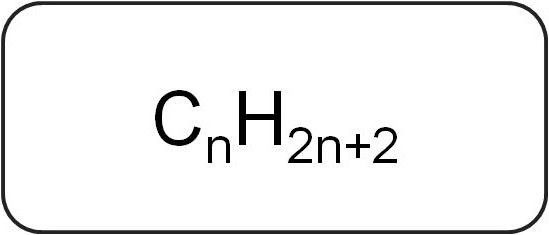
इनमें केवल कार्बन और हाइड्रोजन परमाणु होते हैं। अल्केन्स का सामान्य सूत्र संतृप्त हाइड्रोकार्बन की धारणा से लिया गया है।
अल्केन्स और उनकी विशेषताओं के नाम
इस वर्ग का सबसे सरल प्रतिनिधिमीथेन है। इसके बाद ईथेन, प्रोपेन और ब्यूटेन जैसे पदार्थ होते हैं। उनका नाम ग्रीक में एक संख्या की जड़ पर आधारित है, जिसमें प्रत्यय-एक जोड़ा जाता है। अल्केन नाम IUPAC नामकरण में सूचीबद्ध हैं।
Alkenes, alkynes, alkanes के लिए सामान्य सूत्र शामिल हैंकेवल दो प्रकार के परमाणु। इनमें कार्बन और हाइड्रोजन तत्व शामिल हैं। तीनों वर्गों में कार्बन परमाणुओं की संख्या समान है, अंतर केवल हाइड्रोजन की संख्या में मनाया जाता है, जिसे अलग या संलग्न किया जा सकता है। असंतृप्त यौगिकों को संतृप्त हाइड्रोकार्बन से प्राप्त किया जाता है। अणु में पैराफिन के प्रतिनिधियों में ओलेफिन की तुलना में 2 अधिक हाइड्रोजन परमाणु होते हैं, जो कि अल्केन्स, अल्केन्स के सामान्य सूत्र द्वारा पुष्टि की जाती है। डबल बांड की उपस्थिति के कारण अल्केन्स संरचना को असंतृप्त माना जाता है।
यदि हम अल्कनों में हाइड्रोजन और कार्बन परमाणुओं की संख्या से संबंधित हैं, तो हाइड्रोकार्बन के अन्य वर्गों की तुलना में मूल्य अधिकतम होगा।
मीथेन से शुरू होता है और ब्यूटेन (सी से) के साथ समाप्त होता है1 से सी4), पदार्थ गैसीय रूप में मौजूद हैं।
तरल रूप में, सी से सजातीय अंतराल के हाइड्रोकार्बन5 से सी16... एक अल्केन से शुरू होता है, जिसमें मुख्य श्रृंखला में 17 कार्बन परमाणु होते हैं, भौतिक अवस्था का एक संक्रमण एक ठोस रूप में होता है।
उन्हें कार्बन कंकाल में आइसोमेरिज्म और अणु के ऑप्टिकल संशोधनों की विशेषता है।
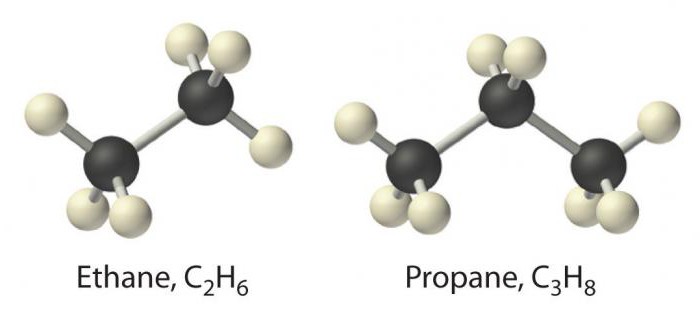
पैराफिन में, कार्बन वैधता पर विचार किया जाता हैपूरी तरह से पड़ोसी कार्बन या हाइड्रोजन्स द्वारा oring-प्रकार के बंधन के गठन के साथ कब्जा कर लिया। एक रासायनिक दृष्टिकोण से, यह उनके कमजोर गुणों का कारण बनता है, यही कारण है कि अल्केन्स को संतृप्त या संतृप्त हाइड्रोकार्बन कहा जाता है, आत्मीयता से रहित।
वे मूलाधार के कट्टरपंथी हलोजन, सल्फोक्लोरेशन या नाइट्रेशन से जुड़े प्रतिस्थापन प्रतिक्रियाओं में प्रवेश करते हैं।
पैराफिन उच्च तापमान पर ऑक्सीकरण, दहन या अपघटन से गुजरते हैं। प्रतिक्रिया त्वरक की कार्रवाई के तहत, हाइड्रोजन परमाणुओं को समाप्त कर दिया जाता है या अल्केन्स को निर्जलित किया जाता है।
अल्केन्स क्या हैं
उन्हें एसिटाइलीनिक हाइड्रोकार्बन भी कहा जाता है, जिनका कार्बन श्रृंखला में एक ट्रिपल बॉन्ड है। अल्केन्स की संरचना सामान्य सूत्र सी द्वारा वर्णित हैnएक्स2एन - 2... इससे यह देखा जा सकता है कि, अल्केन्स के विपरीत, एसिटाइलीनिक हाइड्रोकार्बन में चार हाइड्रोजन परमाणुओं की कमी होती है। उन्हें दो।-यौगिकों द्वारा गठित ट्रिपल बांड द्वारा प्रतिस्थापित किया जाता है।
यह संरचना इस वर्ग के रासायनिक गुणों को निर्धारित करती है। अल्केन्स और अल्केन्स के संरचनात्मक सूत्र स्पष्ट रूप से उनके अणुओं की असंतोषता को दर्शाते हैं, साथ ही एक डबल (एच) की उपस्थिति2C꞊CH2) और ट्रिपल (HC≡CH) बांड।
अल्केन्स और उनकी विशेषताओं का नाम
सबसे सरल प्रतिनिधि एसिटिलीन हैया HC orCH। इसे एथिन भी कहा जाता है। यह एक संतृप्त हाइड्रोकार्बन के नाम से आता है, जिसमें प्रत्यय -न को हटा दिया जाता है और -इन जोड़ा जाता है। लंबे एल्केनीज़ के नामों में, संख्या ट्रिपल बांड के स्थान को इंगित करती है।
संतृप्त की संरचना को जानना औरअसंतृप्त, यह निर्धारित करना संभव है कि किस पत्र के तहत अल्काइन का सामान्य सूत्र इंगित किया गया है: ए) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6। तीसरा विकल्प सही उत्तर है।
एसिटिलीन से शुरू होकर ब्यूटेन (सी से) के साथ समाप्त होता है2 से सी4), पदार्थ एक गैसीय प्रकृति के होते हैं।

तरल रूप में, सी से समरूप अंतराल के हाइड्रोकार्बन होते हैं5 से सी17... एल्केनी के साथ शुरू होता है, जिसमें मुख्य श्रृंखला में 18 कार्बन परमाणु होते हैं, भौतिक अवस्था का ठोस रूप में संक्रमण होता है।
उन्हें कार्बन कंकाल में आइसोमेरिज्म की विशेषता है, ट्रिपल बंधन की स्थिति में, साथ ही अणु के अंतर संशोधनों में भी।
रासायनिक विशेषताओं के संदर्भ में, एसिटाइलीनिक हाइड्रोकार्बन एलिकेंस के समान हैं।
यदि अल्केन्स में एक टर्मिनल ट्रिपल बॉन्ड है, तो वेएल्केनाइड लवण के गठन के साथ एक एसिड का कार्य करते हैं, उदाहरण के लिए, NaCNCNa। दो presence-बंधों की उपस्थिति सोडियम एसीटैलिडाइन अणु को एक मजबूत न्यूक्लियोफाइल बनाती है जो प्रतिस्थापन प्रतिक्रियाओं में प्रवेश करती है।
एसिटिलीन डाइक्लोरोएसेटिलीन प्राप्त करने के लिए कॉपर क्लोराइड की उपस्थिति में क्लोरीनीकरण से गुजरता है, डायक्सेटिलिन अणुओं की रिहाई के साथ हेल्लोकेनेस की कार्रवाई के तहत संघनन।
अल्काइन अतिरिक्त प्रतिक्रियाओं में शामिल हैंइलेक्ट्रोफिलिक, जो का सिद्धांत हैलोजन, जलयोजन, जलयोजन और कार्बोनिलीकरण का आधार है। हालांकि, इस तरह की प्रक्रिया डबल बॉन्ड वाले एलकेनों की तुलना में कमजोर हैं।
एसिटाइलीनिक हाइड्रोकार्बन के लिए, अल्कोहल के न्यूक्लियोफिलिक जोड़ प्रतिक्रियाओं, प्राथमिक अमाइन या हाइड्रोजन सल्फाइड अणु संभव हैं।








