Dans le tableau périodique, il y a un tel élément chimique,comme l'arsenic, il occupe une position sur l'interface métal-non-métal. Dans son activité, il se situe entre l'hydrogène et le cuivre. Le caractère non métallique se manifeste par le fait qu'il est capable de présenter l'état d'oxydation -3 (AsH3 - arsine). Les composés avec un état d'oxydation positif de +3 ont des propriétés amphotères, et ceux avec un degré de +5 présentent des propriétés acides. Qu'est-ce que l'oxyde d'arsenic?

Oxydes et hydroxydes
Les oxydes d'arsenic suivants existent:2Oh3 et comme2Oh5... Il existe également des hydroxydes correspondants:
- Acide méta-arsénique HAsO2.
- Acide orthoarsène H3AsO3.
- Acide métarsénique HAsO3.
- Acide orthoarsénique H3AsO4.
- Acide pyroarsénique H4As2Oh7.

Qu'est-ce que le trioxyde d'arsenic?
L'arsenic forme deux oxydes, dont As2Oh3 porte le nom de trioxyde.C'est une substance souvent utilisée pour le traitement, mais ce n'est pas un produit chimique totalement inoffensif. C'est un composé inorganique qui est la principale source de composés organo-arsenicaux (composés contenant une liaison chimique avec le carbone) et bien d'autres. De nombreuses utilisations d'As2Oh3 sont controversés en raison de la nature toxique de l'élément. Le nom commercial de ce composé est Trisenox.
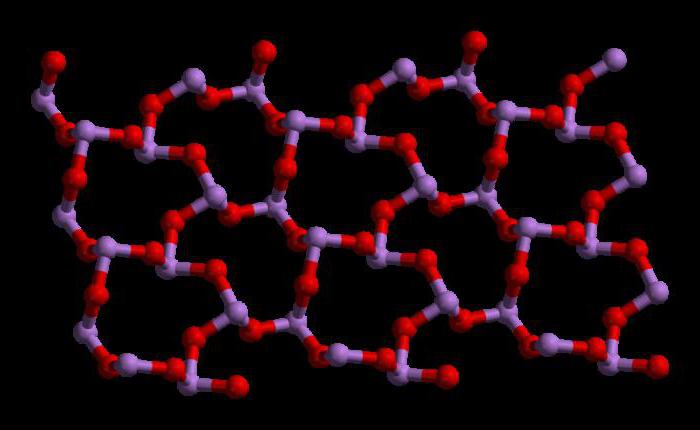
Présentation du trioxyde
La formule chimique du trioxyde d'arsenic est As2Oh3. Молекулярная масса этого соединения составляет 197,841 g / mol. Il existe de nombreuses façons d'obtenir cet oxyde. L'un d'eux est le grillage du minerai sulfuré. La réaction chimique est la suivante:
2As2Oh3 + 9O2 → 2As2Oh3 + 6CO2
La plupart des oxydes peuvent être obtenus encomme sous-produit du traitement d'autres minerais. L'arsénopyrite est une impureté courante dans l'or et le cuivre, et elle libère du trioxyde d'arsenic lorsqu'elle est chauffée en présence d'air. Cela peut entraîner de graves intoxications.

Structure du trioxyde d'arsenic
Le trioxyde d'arsenic a la formule As4Oh6 en phase liquide et gazeuse (inférieure à 800 ° C). Dans ces phases, il est isostructural avec le trioxyde de phosphore (P4Oh6). Mais à des températures supérieures à 800 ° C As4Oh6 se décompose en As moléculaire2Oh3... Dans cette phase, il est isostructural avec le trioxyde de diisotron (N2Oh3). À l'état solide, ce composé présente une capacité polymorphe (la capacité d'exister sous deux ou plusieurs formes de structure cristalline).
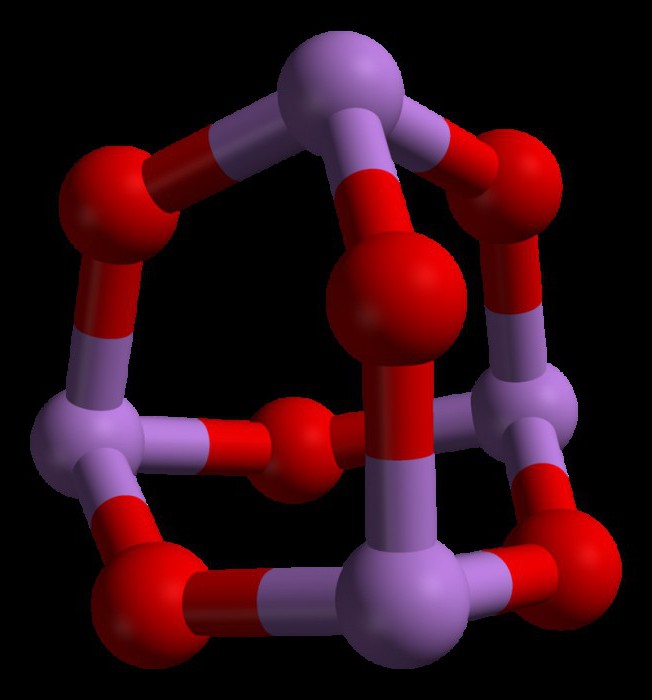
Propriétés du trioxyde d'arsenic
Certaines des principales propriétés du trioxyde d'arsenic sont les suivantes:
- Les solutions de trioxyde forment des acides faibles avec l'eau. C'est parce que le composé est un oxyde d'arsenic amphotère.
- Il est soluble dans les solutions alcalines et donne des arsénates.
- Le trioxyde d'arsenic a une solubilité élevée dans l'acide chlorhydrique (HCl) et donne finalement du trichlorure d'arsenic et de l'acide concentré.
- Il donne du pentoxyde (comme2Oh5) en présence d'oxydants forts tels que le peroxyde d'hydrogène, l'ozone et l'acide nitrique.
- Il est presque insoluble dans les solvants organiques.
- Il ressemble à un solide blanc dans son état physique normal.
- Il a un point de fusion de 312,2 ° C et un point d'ébullition de 465 ° C.
- La densité de cette substance est de 4,15 g / cm3.
L'utilisation du trioxyde d'arsenic en médecine
Ce produit chimique appartient à la classeagents antinéoplasiques et est utilisé dans le traitement du cancer. La toxicité de l'arsenic est bien connue. Mais le trioxyde d'arsenic est un médicament de chimiothérapie et est utilisé pour traiter certains cancers depuis de nombreuses années. La solution utilisée pour ce traitement est appelée solution de Fowler. En 1878, le Boston City Hospital a rapporté que cette solution pourrait être efficace pour réduire le nombre de globules blancs chez l'homme.
En conséquence, comme2Oh3 était principalement utilisé pour traiterleucémie jusqu'à ce qu'elle soit remplacée par la radiothérapie. Mais après les années 1930, il a progressivement retrouvé sa popularité dans le traitement de la leucémie, jusqu'à l'apparition de la chimiothérapie moderne. Cet oxyde d'arsenic était considéré comme le meilleur traitement de la leucémie myéloïde chronique. Même aujourd'hui, cette substance est utilisée pour traiter un type spécifique de leucémie promyélocytaire aiguë avec échec de la chimiothérapie rétinoïde ou anthracycline. Il est également utilisé pour traiter la leucémie myéloïde chronique, le myélome multiple, la leucémie myéloïde aiguë, le lymphome, le cancer lymphatique.

Utilisation de trioxyde
Триоксид мышьяка широко используется в production de verre incolore. Ce composé est également utile dans le domaine de l'électronique pour la fabrication de semi-conducteurs et de certains alliages. Il est également utilisé dans les peintures. Le trioxyde d'arsenic peut s'avérer être un traitement efficace pour les tumeurs cérébrales.
Dans le passé, cette substance était utilisée en dentisterie, mais comme il s'agit d'un composé hautement toxique, son utilisation a été abandonnée par les dentistes modernes. Oxyde d'arsenic (formule As2Oh3) est également utilisé comme agent de préservation du bois, mais ces matériaux sont interdits dans de nombreuses régions du monde. Lorsqu'il est combiné avec de l'acétate de cuivre, le trioxyde d'arsenic produit un pigment vert brillant.
Substance hautement toxique
Le trioxyde lui-même a un taux élevé detoxicité. Par conséquent, il est toujours nécessaire de prendre les précautions nécessaires avant de l'utiliser. Cela peut être très dangereux dans les cas suivants:
- La prise de nourriture. Si comme2Oh3 pénètre accidentellement dans le tube digestif, vous avez besoinconsultez immédiatement un médecin. Il n'est pas recommandé d'essayer de faire vomir avant de consulter un médecin. Vous devez enlever tout vêtement serré, enlever votre cravate, ouvrir le col, la ceinture, etc.
- Contact avec la peau.En cas de contact avec une surface du corps, rincer immédiatement la zone affectée avec beaucoup d'eau. Les vêtements et chaussures contaminés doivent être enlevés immédiatement et lavés avant réutilisation. En cas de contact cutané grave, vous devez consulter immédiatement un médecin. Il peut être utile de laver la zone infectée avec du savon désinfectant et d'appliquer une crème antibactérienne.
- Lentilles de contact. Si comme2Oh3 entre en contact avec les yeux, la première chose à faireà faire est d'enlever les lentilles de contact et de rincer les yeux avec beaucoup d'eau pendant 15 minutes. Nous vous recommandons d'utiliser de l'eau froide. En parallèle, quelqu'un doit appeler une ambulance.
- Inhalation.Les personnes qui ont inhalé ce gaz doivent être déplacées vers un autre endroit avec de l'air frais. Et vous devez également consulter immédiatement un médecin. Si la respiration est difficile, de l'oxygène doit être injecté immédiatement. Si la victime est incapable de respirer par elle-même, la respiration artificielle doit être pratiquée.
- Ce composé peut être toxiqueimpact sur les humains. Le trioxyde d'arsenic peut même être mortel s'il est ingéré en quantités excessives. Des lunettes de sécurité et des gants doivent toujours être portés lorsque vous travaillez avec As2Oh3... Le travail doit toujours être effectué dans un endroit bien ventilé.

Effets secondaires
Les effets secondaires courants de cette substance comprennent des symptômes tels que:
- petit appétit;
- vomissements
- nausée
- douleur abdominale;
- constipation
- mal de tête;
- fatigue
- des vertiges;
- la fièvre;
- difficulté à respirer
- nombre élevé de globules blancs;
- glycémie élevée;
- démangeaison de la peau.
Les effets secondaires moins courants comprennent:
- bouche sèche
- essoufflement;
- douleur thoracique;
- faible nombre de globules blancs;
- douleurs musculaires et osseuses;
- gonflement du visage et des yeux;
- la diarrhée
- tremblement;
- hypoglycémie;
- faibles niveaux d'oxygène dans le sang.
Rare comme effets secondaires2Oh3:
- rythme cardiaque irrégulier (cela peut même entraîner la mort);
- gain de poids;
- évanouissement;
- distraction;
- coma;
- ventre gonflé;
- assombrissement de la peau.
Les symptômes potentiellement mortels de l'exposition au trioxyde d'arsenic sont la prise de poids, la fièvre, les difficultés respiratoires, l'essoufflement, les douleurs thoraciques et la toux.
Le trioxyde d'arsenic est hautement toxiqueune substance qui peut même entraîner la mort d'une personne. Cependant, il a son utilité dans le domaine médical. Des précautions doivent toujours être prises.

Réactions chimiques
Триоксид мышьяка представляет собой амфотерный oxyde d'arsenic supérieur et ses solutions aqueuses sont faiblement acides. Ainsi, il se dissout facilement dans des solutions alcalines pour obtenir des arsénates. Il est moins soluble dans les acides, à l'exception de l'acide chlorhydrique.
Uniquement avec des oxydants forts, tels que l'ozone, le peroxyde d'hydrogène et l'acide nitrique, le penta-oxyde d'arsenic avec une acidité +5 As en est formé2Oh5... En termes de stabilité à l'oxydation, le trioxyde d'arsenic est différent du trioxyde de phosphore, qui brûle facilement en anhydride phosphorique. La réduction donne de l'arsenic élémentaire ou de l'arsine (AsH3).

Pentoxyde d'arsenic
La formule chimique du pentoxyde est As2Oh5... Sa masse molaire est de 229,8402 g / mol. C'est une poudre hygroscopique blanche d'une densité de 4,32 g / cm3... Le point de fusion atteint 315 ° C, àqu'il commence à se décomposer. La substance a une bonne solubilité dans l'eau et l'alcool. Les propriétés de l'oxyde d'arsenic le rendent hautement toxique et dangereux pour l'environnement. C'est un composé inorganique qui est moins abondant, hautement toxique et ne trouve donc qu'une utilisation commerciale limitée, contrairement à l'oxyde d'arsenic plus élevé (formule As2Oh3).
L'arsenic est principalement connu comme un poison etcancérigène. Son trioxyde est une poudre soluble dans l'eau qui produit une solution incolore, insipide et inodore. C'était une méthode de meurtre populaire au Moyen Âge. Son utilisation se poursuit aujourd'hui, mais à des fins pacifiques et en petites quantités.



