Οι δυαδικές ενώσεις είναι ουσίες που σχηματίζονται από δύο διαφορετικά χημικά στοιχεία. Αυτός ο όρος χρησιμοποιείται για να δηλώσει την ποιοτική και ποσοτική σύνθεση ανόργανων ενώσεων.
Οι δυαδικές χημικές ενώσεις θεωρούνται σημαντικέςαντικείμενο στη μελέτη της φύσης των ουσιών. Κατά την περιγραφή τους, χρησιμοποιούνται οι ακόλουθες έννοιες: πόλωση δεσμών, κατάσταση οξείδωσης, σθένος. Αυτοί οι χημικοί όροι καθιστούν δυνατή την κατανόηση της ουσίας του σχηματισμού ενός χημικού δεσμού, των δομικών χαρακτηριστικών των ανόργανων ουσιών.
Εξετάστε τις κύριες κατηγορίες δυαδικών ενώσεων, τα χαρακτηριστικά της χημικής δομής και των ιδιοτήτων τους, καθώς και ορισμένους τομείς της βιομηχανικής τους εφαρμογής.

Οξείδια
Αυτή η κατηγορία ανόργανων ουσιών είναι η πιο κοινή στη φύση. Μεταξύ των γνωστών εκπροσώπων αυτής της ομάδας ενώσεων, επισημαίνουμε:
- οξείδιο του πυριτίου (άμμος του ποταμού) ·
- υδροξείδιο (νερό) ·
- διοξείδιο του άνθρακα;
- άργιλος (οξείδιο του αργιλίου)
- σιδηρομετάλλευμα (οξείδια σιδήρου).
Αυτές οι δυαδικές ενώσεις είναι σύνθετες ουσίες, οι οποίες περιέχουν απαραίτητα οξυγόνο, το οποίο εμφανίζει κατάσταση οξείδωσης -2.
Συγκεντρωτική κατάσταση οξειδίων
Οι ενώσεις χαλκού, ασβεστίου και σιδήρου είναικρυσταλλικά στερεά. Τα οξείδια ορισμένων μη μετάλλων έχουν την ίδια κατάσταση συσσωμάτωσης, για παράδειγμα, εξασθενές θείο, πεντασθενή φωσφόρο, πυρίτιο. Το υγρό υπό κανονικές συνθήκες είναι νερό. Η συντριπτική πλειονότητα των ενώσεων οξυγόνου των μη μετάλλων είναι αέρια.
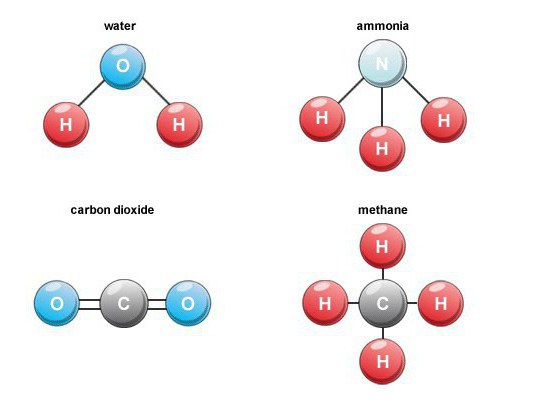
Εκπαιδευτικά χαρακτηριστικά
Σχηματίζονται πολλές δυαδικές ενώσεις οξυγόνουστη φύση. Για παράδειγμα, κατά την καύση καυσίμου, αναπνοή, αποσύνθεση οργανικής ύλης, σχηματίζεται διοξείδιο του άνθρακα (μονοξείδιο του άνθρακα 4). Στον αέρα, το ογκομετρικό του περιεχόμενο είναι περίπου 0,03 τοις εκατό.
Παρόμοιες δυαδικές ενώσεις είναι προϊόνταδραστηριότητα των ηφαιστείων, καθώς και αναπόσπαστο μέρος του μεταλλικού νερού. Το διοξείδιο του άνθρακα δεν υποστηρίζει την καύση, επομένως αυτή η χημική ένωση χρησιμοποιείται για την κατάσβεση των πυρκαγιών.
Πτητικές ενώσεις υδρογόνου
Τέτοιες δυαδικές ενώσεις είναι μια σημαντική ομάδα.ουσίες που περιέχουν υδρογόνο. Μεταξύ των εκπροσώπων βιομηχανικής σημασίας, παρατηρούμε το μεθάνιο, το νερό, το υδρόθειο, την αμμωνία, και επίσης τα αλογονίδια υδρογόνου.
Μερικές από τις πτητικές ενώσεις υδρογόνου υπάρχουν στα ύδατα του εδάφους, στους ζωντανούς οργανισμούς, έτσι μπορούμε να μιλήσουμε για τον γεωχημικό και βιοχημικό τους ρόλο.
Για τη σύνθεση δυαδικών ενώσεων αυτού του τύπου, το υδρογόνο, που έχει σθένος, τοποθετείται στην πρώτη θέση. Το δεύτερο στοιχείο είναι ένα μη μέταλλο με αρνητική κατάσταση οξείδωσης.
Για να τακτοποιήσετε τους δείκτες σε μια δυαδική ένωσητο λιγότερο κοινό πολλαπλάσιο καθορίζεται μεταξύ των σθένους. Ο αριθμός ατόμων κάθε στοιχείου προσδιορίζεται διαιρώντας το με το σθένος κάθε στοιχείου που είναι μέρος της ένωσης.

Υδροχλωρίδιο
Εξετάστε τους τύπους για δυαδικές ενώσεις:υδροχλώριο και αμμωνία. Αυτές οι ουσίες είναι σημαντικές για τη σύγχρονη χημική βιομηχανία. Το HCl υπό κανονικές συνθήκες είναι μια αέρια ένωση που είναι πολύ διαλυτή στο νερό. Μετά τη διάλυση αερίου υδροχλωρίου, σχηματίζεται υδροχλωρικό οξύ, το οποίο χρησιμοποιείται σε πολλές χημικές διεργασίες και βιομηχανικές αλυσίδες.
Αυτή η δυαδική ένωση βρίσκεται στον γαστρικό χυμό ανθρώπων και ζώων, αποτελεί εμπόδιο για παθογόνα μικρόβια που διεισδύουν στο στομάχι με τροφή.
Μεταξύ των κύριων τομέων εφαρμογής υδροχλωρικού οξέος, επισημαίνουμε την παραγωγή χλωριδίων, τη σύνθεση προϊόντων που περιέχουν χλώριο, χάραξη μετάλλων, καθαρισμό σωλήνων από οξείδια και ανθρακικά άλατα και παραγωγή δέρματος.
Η αμμωνία έχει τον τύπο NH3, είναι ένα άχρωμο αέριο μεσυγκεκριμένη πικάντικη μυρωδιά. Η απεριόριστη διαλυτότητά του στο νερό καθιστά δυνατή την απόκτηση αμμωνίας, η οποία έχει ζήτηση στην ιατρική. Στη φύση, αυτή η δυαδική ένωση σχηματίζεται κατά τη διαδικασία της αποσύνθεσης των οργανικών προϊόντων, τα οποία περιέχουν άζωτο.

Ταξινόμηση των οξειδίων
Η περιέχουσα οξυγόνο δυαδική ένωση ενός μετάλλου που έχει σθένος 1 ή 2 είναι το βασικό οξείδιο. Για παράδειγμα, αυτή η ομάδα περιλαμβάνει οξείδια αλκαλικών και αλκαλικών γαιών.
Οξείδια μη μετάλλων, καθώς και μέταλλα με σθένος άνω των 4, είναι όξινες ενώσεις.
Ανάλογα με τις χημικές ιδιότητες, οι εκπρόσωποι αυτής της κατηγορίας χωρίζονται σε ομάδες που σχηματίζουν αλάτι και που δεν σχηματίζουν άλατα.
Μεταξύ των τυπικών εκπροσώπων της δεύτερης ομάδας, σημειώνουμε το μονοξείδιο του άνθρακα (CO), το οξείδιο του αζώτου 1 (ΟΧΙ).
Σχηματισμός συστηματικών ονομάτων ενώσεων
Μεταξύ των καθηκόντων που προσφέρονται στους αποφοίτους που περνούνκρατική εξέταση στη χημεία, υπάρχει επίσης αυτό: "Αποτελέστε τους μοριακούς τύπους πιθανών δυαδικών ενώσεων οξυγόνου θείου (άζωτο, φώσφορος)." Προκειμένου να αντιμετωπιστεί η υπό εξέταση εργασία, είναι απαραίτητο να έχουμε μια ιδέα όχι μόνο για τον αλγόριθμο, αλλά και για τα χαρακτηριστικά της ονοματολογίας αυτής της κατηγορίας ανόργανων ουσιών.
Κατά τη διαμόρφωση του ονόματος του δυαδικούενώσεις, αρχικά δείχνουν το στοιχείο που βρίσκεται στα δεξιά στον τύπο, προσθέτοντας το επίθημα "id". Στη συνέχεια, υποδείξτε το όνομα του πρώτου στοιχείου. Για ομοιοπολικές ενώσεις, προστίθενται προθέματα, με τα οποία μπορείτε να προσδιορίσετε ποσοτική αναλογία μεταξύ των συστατικών τμημάτων μιας δυαδικής ένωσης.
Για παράδειγμα, SO3 - τριοξείδιο του θείου, Ν2Ω4 - τετροξείδιο του αζώτου, I2CL6 - εξαχλωριούχος δίοδος.
Εάν ένα χημικό στοιχείο υπάρχει σε δυαδική ένωση που μπορεί να εμφανίσει διαφορετικές καταστάσεις οξείδωσης, η κατάσταση οξείδωσης υποδεικνύεται σε παρένθεση μετά το όνομα της ένωσης.
Για παράδειγμα, δύο ενώσεις σιδήρου διαφέρουν στο όνομα: FeCL3 - οξείδιο του σιδήρου (3), FeCL2 - οξείδιο του σιδήρου (2).
Για υδρίδια, ιδίως μη μεταλλικά στοιχεία, χρησιμοποιούν ασήμαντα ονόματα. Λοιπόν, Χ2O - νερό, HCL - υδροχλώριο, HI - υδρογόνο ιωδιούχο, HF - υδροφθορικό οξύ.

Κατιόντα
Θετικά ιόντα αυτών των στοιχείων πουικανός να σχηματίσει μόνο ένα σταθερό ιόν, να δώσει τα ίδια ονόματα με τα ίδια τα σύμβολα. Σε αυτούς περιλαμβάνονται όλοι οι εκπρόσωποι της πρώτης και δεύτερης ομάδας του περιοδικού συστήματος του Μεντελέγιεφ.
Για παράδειγμα, τα κατιόντα νατρίου και μαγνησίου έχουν τη μορφή: Na+, Mg2+... Τα μεταβατικά στοιχεία είναι ικανά να σχηματίσουν διάφορους τύπους κατιόντων, επομένως, το όνομα πρέπει να υποδηλώνει το σθένος που εκδηλώνεται σε κάθε μεμονωμένη περίπτωση.
Ανιόνια
Για απλά (μονοατομικά) και σύνθετα (πολυατομικά) ανιόντα, χρησιμοποιείται το επίθημα –id.
Ένα ευρέως διαδεδομένο oxoanion κάποιουτο στοιχείο είναι επίθημα -am. Για το οξοανιόν ενός στοιχείου στον τύπο με χαμηλότερη κατάσταση οξείδωσης, χρησιμοποιείται το επίθημα – αυτό. Για την ελάχιστη κατάσταση οξείδωσης, χρησιμοποιείται το πρόθεμα hypo και για τη μέγιστη τιμή χρησιμοποιείται το πρόθεμα. Για παράδειγμα, το ιόν Ο2- είναι ένα ιόν οξειδίου και O- - υπεροξείδιο.
Υπάρχουν επίσης διάφορα ασήμαντα ονόματα για υδρίδια. Για παράδειγμα, Ν2Χ4 ονομάζεται υδραζίνη και PH3 ονομάζεται φωσφίνη.
Τα οξοανιονίδια που περιέχουν θείο έχουν τα ακόλουθα ονόματα:
- CO42- - θειικό ·
- Με2Ω32- - θειοθειικό ·
- NCS- - θειοκυανικό.
Αλας
Πολλές τελικές δοκιμές χημείας προτείνουνη επόμενη εργασία: "Δημιουργήστε τύπους για δυαδικά μεταλλικά συστατικά." Εάν τέτοιες ενώσεις περιέχουν ανιόντα χλωρίου, βρωμίου, ιωδίου, αυτές οι ενώσεις ονομάζονται αλογονίδια και ανήκουν στην κατηγορία των αλάτων. Κατά την κατάρτιση των τύπων αυτών των δυαδικών ενώσεων, το μέταλλο τοποθετείται πρώτο και μετά το αντίστοιχο ιόν αλογονιδίου.
Για τον προσδιορισμό του αριθμού των ατόμων κάθε στοιχείου, το μικρότερο πολλαπλό μεταξύ των σθένους βρίσκεται, και κατά τη διαίρεση, λαμβάνονται δείκτες.
Αυτές οι ενώσεις έχουν υψηλό σημείο τήξεωςκαι βρασμό, καλή διαλυτότητα στο νερό, υπό κανονικές συνθήκες είναι στερεά. Για παράδειγμα, χλωριούχα νάτριο και κάλιο βρίσκονται στο θαλασσινό νερό.
Οι άνθρωποι χρησιμοποιούν επιτραπέζιο αλάτι από την αρχαιότητα.Επί του παρόντος, η χρήση αυτής της δυαδικής ένωσης δεν περιορίζεται στην κατανάλωση τροφίμων. Η ηλεκτρόλυση ενός υδατικού διαλύματος χλωριούχου νατρίου παράγει μεταλλικό νάτριο και αέριο χλώριο. Αυτά τα προϊόντα χρησιμοποιούνται σε διάφορες βιομηχανικές διεργασίες, για παράδειγμα για την παραγωγή υδροξειδίου του νατρίου, υδροχλωρίου.
Η έννοια των δυαδικών ενώσεων
Αυτή η ομάδα περιλαμβάνει έναν τεράστιο αριθμόουσίες, επομένως μπορούμε να μιλήσουμε με αυτοπεποίθηση για το μέγεθος της χρήσης τους σε διάφορους τομείς της ανθρώπινης δραστηριότητας. Η αμμωνία στη χημική βιομηχανία χρησιμοποιείται ως πρόδρομος στην παραγωγή νιτρικού οξέος, στην παραγωγή ορυκτών λιπασμάτων. Είναι αυτή η δυαδική ένωση που χρησιμοποιείται στη λεπτή οργανική σύνθεση και χρησιμοποιείται εδώ και πολύ καιρό σε ψυκτικές μονάδες.
Λόγω της μοναδικής σκληρότητας του καρβιδίου βολφραμίου,Αυτή η ένωση έχει βρει εφαρμογή στην κατασκευή διαφόρων εργαλείων κοπής. Η χημική αδράνεια αυτής της δυαδικής ένωσης το επιτρέπει να χρησιμοποιείται σε επιθετικά περιβάλλοντα: εργαστηριακός εξοπλισμός, φούρνοι.
Το αέριο γέλιου (νιτρικό οξείδιο 1) αναμεμιγμένο με οξυγόνο χρησιμοποιείται στην ιατρική για γενική αναισθησία.
Όλες οι δυαδικές ενώσεις έχουν ομοιοπολικό ή ιοντικό χημικό δεσμό, μοριακό, ιοντικό ή ατομικό κρυσταλλικό πλέγμα.

Συμπέρασμα
Κατά την κατάρτιση τύπων για δυαδικές ενώσειςείναι απαραίτητο να ακολουθήσετε μια συγκεκριμένη ακολουθία ενεργειών. Πρώτον, καταγράφεται το στοιχείο που εμφανίζει θετική κατάσταση οξείδωσης (έχει χαμηλότερη ηλεκτρική αρνητικότητα). Κατά τον προσδιορισμό της τιμής της κατάστασης οξείδωσης του δεύτερου στοιχείου, ο αριθμός ομάδας στην οποία βρίσκεται αφαιρείται από οκτώ. Εάν οι λαμβανόμενοι αριθμοί διαφέρουν ο ένας από τον άλλο, προσδιορίζεται το λιγότερο κοινό πολλαπλάσιο, τότε υπολογίζονται οι δείκτες.
Εκτός από τα οξείδια, αυτές οι ενώσεις περιλαμβάνουνκαρβίδια, πυριτίδια, υπεροξείδια, υδρίδια. Τα καρβίδια του αργιλίου και του ασβεστίου χρησιμοποιούνται για την εργαστηριακή παραγωγή μεθανίου και ακετυλενίου · τα υπεροξείδια χρησιμοποιούνται στη χημική βιομηχανία ως ισχυρά οξειδωτικά.
Ένα αλογονίδιο όπως το υδροφθόριο (υδροφθορικόοξύ), που χρησιμοποιείται στην ηλεκτρολογία για συγκόλληση. Μεταξύ των πιο σημαντικών δυαδικών ενώσεων, χωρίς τις οποίες είναι δύσκολο να φανταστεί κανείς την ύπαρξη ζωντανών οργανισμών, το νερό είναι το προβάδισμα. Τα δομικά χαρακτηριστικά αυτής της ανόργανης ένωσης μελετώνται λεπτομερώς στο μάθημα χημείας του σχολείου. Είναι στο παράδειγμά της ότι τα παιδιά παίρνουν μια ιδέα για την ακολουθία των ενεργειών κατά την κατάρτιση τύπων για δυαδικές ενώσεις.
Συμπερασματικά, σημειώνουμε ότι είναι δύσκολο να βρεθεί μια τέτοια σφαίρα της σύγχρονης βιομηχανίας, ένας τομέας της ανθρώπινης ζωής, όπου χρησιμοποιούνται διάφορες δυαδικές ενώσεις.