Vieles in der Quantenmechanik bleibt jenseits der GrenzenVerständnis scheint viel fantastisch. Gleiches gilt für Quantenzahlen, deren Natur bis heute rätselhaft ist. Der Artikel beschreibt das Konzept, die Typen und die allgemeinen Prinzipien der Arbeit mit ihnen.
Allgemeine Eigenschaften

Ganzzahlige oder halbzahlige Quantenzahlen für physikalischeGrößen bestimmen alle Arten von diskreten Werten, die Quantensysteme (Molekül, Atom, Kern) und Elementarteilchen charakterisieren. Ihre Verwendung hängt eng mit der Existenz der Planck-Konstante zusammen. Die Diskretion der im Mikrokosmos ablaufenden Prozesse spiegelt die Quantenzahlen und ihre physikalische Bedeutung wider. Sie wurden zuerst eingeführt, um die Gesetze zu beschreiben, die die Spektren eines Atoms regeln. Die physikalische Bedeutung und Diskretion einzelner Größen wurde jedoch nur in der Quantenmechanik offenbart.
Eine Menge, die einen vollständigen Zustand definiertDieses System heißt komplett. Alle Zustände, die für mögliche Werte aus einer solchen Menge verantwortlich sind, bilden ein vollständiges Zustandssystem. Quantenzahlen in der Chemie mit den Freiheitsgraden des Elektrons bestimmen es in drei Raumkoordinaten und dem inneren Freiheitsgrad - dem Spin.
Konfigurationen von Elektronen in Atomen
Ein Atom enthält einen Kern und Elektronen dazwischendurch die die Kräfte elektrostatischer Natur wirken. Die Energie nimmt zu, wenn der Abstand zwischen dem Kern und dem Elektron abnimmt. Es wird angenommen, dass die potentielle Energie Null ist, wenn sie unendlich vom Kern entfernt wird. Dieser Zustand wird als Referenzpunkt verwendet. Somit wird die relative Energie des Elektrons bestimmt.
Die Elektronenhülle besteht aus einer Reihe von Energieniveaus. Zu einem von ihnen zu gehören, wird durch die Hauptquantenzahl n ausgedrückt.

Hauptnummer
Es bezieht sich auf ein bestimmtes Energieniveau miteine Menge von Orbitalen mit ähnlichen Werten, bestehend aus natürlichen Zahlen: n = 1, 2, 3, 4, 5 ... Wenn sich ein Elektron von einer Ebene zur anderen bewegt, ändert sich die Hauptquantenzahl. Es ist zu beachten, dass nicht alle Ebenen mit Elektronen gefüllt sind. Beim Füllen der Hülle eines Atoms wird das Prinzip der geringsten Energie umgesetzt. In diesem Fall wird sein Zustand als nicht erregt oder grundlegend bezeichnet.
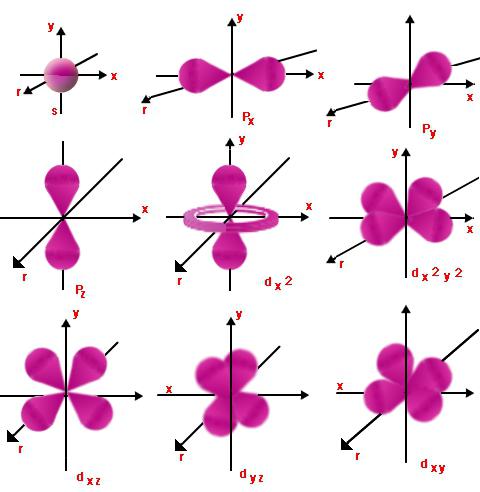
Orbitalzahlen
Jedes Level hat Orbitale. Diejenigen von ihnen mit ähnlicher Energie bilden eine Unterebene. Eine solche Zuordnung erfolgt unter Verwendung der Orbitalquantenzahl (oder, wie sie auch als Nebenquantenzahl l bezeichnet wird), die die Werte von ganzen Zahlen von null bis n - 1 annimmt. Ein Elektron mit den Haupt- und Orbitalquantenzahlen n und l kann also gleich l sein, beginnend mit l = 0 und endet mit l = n - 1.
Dies zeigt die Art der Bewegung des jeweiligenUnterebene und Energieniveau. Für l = 0 und einen beliebigen Wert von n hat die Elektronenwolke die Form einer Kugel. Sein Radius ist direkt proportional zu n. Bei l = 1 hat die Elektronenwolke die Form von unendlich oder acht. Je größer der Wert von l ist, desto komplexer wird die Form und die Elektronenenergie nimmt zu.
Magnetische Zahlen
Ml ist die Projektion des Orbitals (Seite)Drehimpuls in die eine oder andere Richtung des Magnetfeldes. Es zeigt die räumliche Ausrichtung der Orbitale, für die die Zahl l gleich ist. Ml kann unterschiedliche Werte 2l + 1 haben, von -l bis +l.
Eine andere magnetische Quantenzahl heißtspin - ms, das ist der richtige Moment für die Anzahl der Bewegungen. Um dies zu verstehen, kann man sich die Rotation des Elektrons sozusagen um seine eigene Achse vorstellen. Frau kann -1/2, +1/2, 1 sein.
Im Allgemeinen ist für jedes Elektron der Absolutwert des Spins s = 1/2, und ms bedeutet seine Projektion auf die Achse.
Paulis Prinzip: Ein Atom kann nicht zwei Elektronen mit 4 ähnlichen Quantenzahlen enthalten. Mindestens einer von ihnen sollte großartig sein.
Die Regel der Erstellung der Atomformeln.
- Das Prinzip der minimalen Energie. Darauf werden zunächst die Ebenen und Unterebenen, die sich näher am Kern befinden, nach Klechkovskys Regeln gefüllt.
- Die Position des Elements gibt an, wie die Elektronen auf Energieniveaus und Unterebenen verteilt sind:
- die Anzahl stimmt mit der Ladung des Atoms und der Anzahl seiner Elektronen überein;
- die periodische Anzahl entspricht der Anzahl der Energieniveaus;
- die Gruppennummer stimmt mit der Anzahl der Valenzelektronen im Atom überein;
- Die Untergruppe zeigt ihre Verteilung.

Elementarteilchen und Kerne
Quantenzahlen in der Teilchenphysiksind ihre inneren Eigenschaften, die die Wechselwirkungen und Gesetze der Transformation bestimmen. Zusätzlich zu den Spins ist dies die elektrische Ladung Q, die für alle Elementarteilchen Null oder eine ganze Zahl ist, negativ oder positiv; baryonische Ladung B (in einem Teilchen - null oder eins, in einem Antiteilchen - null oder minus eins); Leptonladungen, wobei Le und Lm gleich Null, Eins und im Antiteilchen sind - Null und Minus Eins; Isotopenspin mit einer ganzen oder einer halben ganzen Zahl; Fremdheit S und andere. Alle diese Quantenzahlen gelten sowohl für Elementarteilchen als auch für Atomkerne.
Im weitesten Sinne des Wortes werden sie physisch genanntGrößen, die die Bewegung eines Partikels oder Systems bestimmen und die erhalten bleiben. Es ist jedoch überhaupt nicht notwendig, dass sie zu einem diskreten Spektrum aller möglichen Werte gehören.









