Hydroxid sodný nebo hydroxid sodný - anorganickýsloučenina, která patří do třídy bází nebo hydroxidů. Také v technologii i v zahraničí se tato látka nazývá louh sodný. Triviální název - žíravina - dostala se kvůli silnému koroznímu účinku.

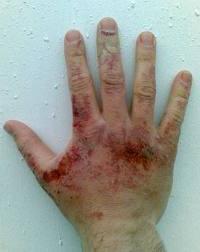
Po rozpuštění ve vodě tvoří účinnou látku- alkalické látky, - mýdlo na dotyk. Tato reakce probíhá velmi rychle - s rozstřikem a uvolněním tepla. Jedná se o požití alkalických látek na pokožce a sliznici, což způsobuje těžké chemické popáleniny, takže při práci je třeba dbát opatrnosti a chránit ruce a oči. Pokud se tato látka dostane na epiteli nebo do očí, úst, je nutné postižené oblasti vypláchnout vodou a slabým roztokem kyseliny octové (2%) nebo kyseliny borité (3%) co nejdříve a pak znovu vodou. Po poskytnutí nouzové péče by měla být oběť předána lékaři.
Hydroxid sodný (vzorec chemické sloučeniny- NaOH, stratura - Na-O-H) je reaktivní látka, která může reagovat s anorganickými i organickými látkami. Detekce ve vodných roztokech pomůže kvalitativní reakci na hydroxidové ionty s různými indikátory. Laktmusový indikátor se tmavě modrý, oranžově žlutý a fenolftalein - karmínový, zatímco intenzita barvy závisí na koncentraci alkalických látek.
Do těchto reakcí vstupuje hydroxid sodný:
1.neutralizace kyselinami, oxidy kyselin a amfoterní sloučeniny. Výsledkem této reakce je tvorba vody a soli nebo hydrox-komplexu - v případě interakce s amfoterními bázemi a oxidy;
2. výměna se solemi;
3. s kovy, které jsou až do vodíku v řadě Beketov a mají nízký elektrochemický potenciál;
4. s nekovy a halogeny;
4. hydrolýza s estery;
5. Saponifikace s tuky (tvoří mýdlo a glycerin);
6. interakce s alkoholy (vytvářejí se alkoholáty).

Také v roztavené formě hydroxidu sodného může zničit porcelánu a skla, a přítomnost kyslíku - ušlechtilý kov (platina).
Hydroxid sodný lze získat těmito způsoby:
- elektrolýza vodného roztoku chloridu sodného (membránová a membránová metoda),
- chemická (vápenná a feritická metoda).
V posledních letech se nejčastěji používají metody založené na elektrolýze jsou výhodnější.
Louh sodný používá velkýpopularita a používá se v mnoha odvětvích - kosmetické, buničiny a papíru, chemické, textilní, potravinářské. Používá se jako přísada E-524 pro odplynění prostorů a pro získání bionafty.
Takto je hydroxid sodný alkalický, který se díky své chemicky aktivní povaze široce používá v různých odvětvích lidské ekonomické činnosti.





