Under lång tid har forskare försökt härleda en singelen teori som skulle förklara molekylernas struktur, beskriva deras egenskaper i förhållande till andra ämnen. För att göra detta var de tvungna att beskriva atomens natur och struktur, introducera begreppen "valens", "elektrontäthet" och många andra.
Bakgrund till teorin

Den kemiska strukturen hos ämnen var den första som intresserade sigItalienska Amadeus Avogadro. Han började studera vikten av molekyler av olika gaser och baserade på sina observationer en hypotes om deras struktur. Men han var inte den första som rapporterade om det, men väntade tills hans kollegor fick liknande resultat. Därefter blev metoden för att erhålla gasernas molekylvikt känd som Avogadros lag.
Den nya teorin fick andra forskare att forska. Bland dem var Lomonosov, Dalton, Lavoisier, Proust, Mendeleev och Butlerov.
Butlerovs teori

Formuleringen "teori om kemisk struktur"uppträdde först i en rapport om ämnens struktur, som 1861 i Tyskland representerades av Butlerov. Hon gick in i de efterföljande publikationerna utan ändringar och fixades i vetenskapshistoriaens annaler. Detta förskådde flera nya teorier. I sitt dokument skisserade forskaren sin egen syn på ämnens kemiska struktur. Här är några av hans teser:
- atomer i molekyler ansluter till varandra baserat på antalet elektroner i deras yttre orbitaler;
- en förändring i sekvensen av sammanfogande atomer leder till en förändring av egenskaperna hos en molekyl och uppkomsten av en ny substans;
- ämnens kemiska och fysikaliska egenskaper beror inte bara på vilka atomer som ingår i dess sammansättning utan också på ordningen av deras koppling till varandra, liksom ömsesidigt inflytande
- För att bestämma ämnets molekylära och atomsammansättning är det nödvändigt att genomföra en kedja av successiva transformationer.
Molekylers geometriska struktur

Den kemiska strukturen hos atomer och molekyler varkompletterat tre år senare av Butlerov själv. Han introducerar isomerismens fenomen i vetenskapen och postulerar att, även med samma kvalitativa sammansättning, men med en annan struktur, kommer ämnen att skilja sig från varandra i ett antal indikatorer.
Tio år senare framträder doktrinen om tredimensionellmolekylär struktur. Allt börjar med att Van't Hoff publicerar sin teori om det kvartära systemet för valenser i kolatomen. Moderna forskare skiljer mellan två områden av stereokemi: strukturell och rumslig.
I sin tur är den strukturella delen också uppdelad iskelettisomerism och position. Detta är viktigt att ta hänsyn till när man studerar organiska ämnen, när deras kvalitativa sammansättning är statisk, och endast antalet väte- och kolatomer och sekvensen av deras föreningar i molekylen är föremål för dynamik.
Rumlig isomerism är viktigt i dessafall då det finns föreningar vars atomer ligger i samma ordning, men i rymden är molekylen placerad annorlunda. Optisk isomerism (när stereoisomerer speglar varandra), diastereomerism, geometrisk isomerism och andra särskiljs.
Atomer i molekyler

Molekylens klassiska kemiska strukturinnebär närvaron av en atom i den. Det är hypotetiskt tydligt att själva atomen i en molekyl kan förändras, och dess egenskaper kan också förändras. Det beror på vilka andra atomer som omger det, avståndet mellan dem och bindningarna som ger molekylens styrka.
Moderna forskare som vill förena allmän teorirelativitet och kvantteori, tar som utgångspunkt det faktum att när en molekyl bildas lämnar en atom den bara en kärna och elektroner och i sig upphör att existera. Naturligtvis kom de inte till en sådan formulering direkt. Flera försök har gjorts för att bevara atomen som en enhet i molekylen, men alla har inte lyckats tillfredsställa det kräsna sinnet.
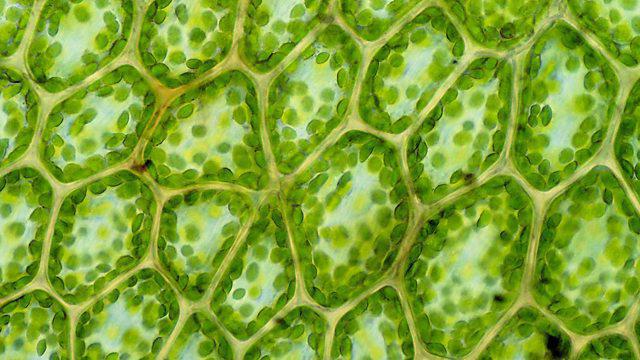
Struktur, cellens kemiska sammansättning
Begreppet "komposition" betyder förening av alla ämnen som är involverade i cellens bildande och liv. Denna lista innehåller nästan hela tabellen med periodiska element:
- Åttiosex element är ständigt närvarande.
- tjugofem av dem är deterministiska för det normala livet;
- Cirka tjugo till är absolut nödvändiga.
De fem bästa vinnarna öppnas med syre, innehållsom i cellen når sjuttiofem procent i varje cell. Det bildas under nedbrytningen av vatten, är nödvändigt för reaktionerna av cellulär andning och ger energi för andra kemiska interaktioner. Nästa vikt är kol. Det är grunden för alla organiska ämnen och är också ett substrat för fotosyntes. Brons får väte - det vanligaste elementet i universum. Det finns också i organiska föreningar i nivå med kol. Det är en viktig komponent i vatten. En ära fjärde plats upptar kväve, vilket är nödvändigt för bildandet av aminosyror och som ett resultat proteiner, enzymer och till och med vitaminer.
Cellens kemiska struktur innehåller mindrepopulära element såsom kalcium, fosfor, kalium, svavel, klor, natrium och magnesium. Tillsammans upptar de ungefär en procent av den totala mängden substans i cellen. Mikroelement och ultramikroelement, som finns i levande organismer i spårmängder, utmärks också.