Dôležitý je pojem chemická väzbavýznam v rôznych oblastiach chémie ako vedy. Je to spôsobené tým, že práve s jeho pomocou sa jednotlivé atómy dokážu spájať do molekúl, pričom vytvárajú všetky druhy látok, ktoré sú zase predmetom chemického výskumu.
Rozmanitosť atómov a molekúl je spojená so vznikom rôznych typov väzieb medzi nimi. Rôzne triedy molekúl sa vyznačujú svojimi vlastnými charakteristikami distribúcie elektrónov, a teda aj vlastnými typmi väzieb.
Základné pojmy
Chemická väzba množinu interakcií nazývajte takvedú k väzbe atómov za vzniku stabilných častíc zložitejšej štruktúry (molekuly, ióny, radikály), ako aj agregátov (kryštály, sklá a pod.). Povaha týchto interakcií je elektrická a vznikajú pri distribúcii valenčných elektrónov v približujúcich sa atómoch.
Valence prijal pomenovať schopnosť atómuvytvárajú určitý počet väzieb s inými atómami. V iónových zlúčeninách sa ako valenčná hodnota berie počet darovaných alebo pripojených elektrónov. V kovalentných zlúčeninách sa rovná počtu spoločných elektrónových párov.
pod oxidačný stav sa chápe ako podmienený náboj, ktorý by mohol byť na atóme, keby všetky polárne kovalentné väzby boli iónové.
Mnohonásobnosť komunikácie je tzv počet zdieľaných elektrónových párov medzi uvažovanými atómami.
Väzby uvažované v rôznych odvetviach chémie možno rozdeliť na dva typy chemických väzieb: tie, ktoré vedú k tvorbe nových látok (intramolekulárne)a tie, ktoré vznikajú medzi molekulami (intermolekulové).
Základné komunikačné charakteristiky
Energiou komunikácie sa nazýva energia, ktorá je potrebná na prerušenie všetkých existujúcich väzieb v molekule. Je to tiež energia uvoľnená pri vytváraní väzby.
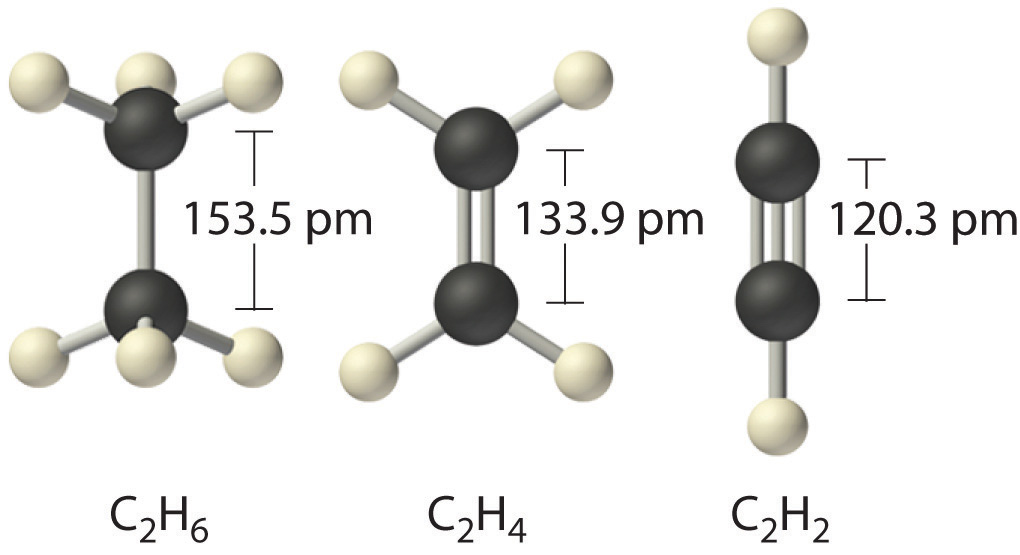
Dĺžka komunikácie sa týka vzdialenosti medzi susednými jadrami atómov v molekule, pri ktorej sú sily príťažlivosti a odpudzovania vyrovnané.
Tieto dve charakteristiky chemickej väzby atómov sú mierou jej sily: čím kratšia je dĺžka a čím väčšia je energia, tým silnejšia je väzba.
Valenčný uhol je zvykom nazývať uhol medzi znázornenými čiarami prechádzajúcimi v smere väzby cez jadrá atómov.
Metódy opisu vzťahu
Najbežnejšie sú dva prístupy na vysvetlenie chemickej väzby, požičané z kvantovej mechaniky:
Molekulárna orbitálna metóda. Na molekulu sa pozerá ako na agregátelektróny a jadrá atómov a každý jednotlivý elektrón sa pohybuje v poli pôsobenia všetkých ostatných elektrónov a jadier. Molekula má orbitálnu štruktúru a všetky jej elektróny sú distribuované pozdĺž týchto dráh. Táto metóda sa tiež nazýva MO LCAO, čo znamená "molekulárny orbitál - lineárna kombinácia atómových orbitálov".
Metóda valenčných väzieb. Predstavuje molekulu ako systém dvoch centrálmolekulové orbitály. Navyše každý z nich zodpovedá jednej väzbe medzi dvoma susednými atómami v molekule. Metóda je založená na nasledujúcich ustanoveniach:
- Tvorba chemickej väzby sa uskutočňuje pomocou páruelektróny s opačnými spinmi, ktoré sa nachádzajú medzi dvoma uvažovanými atómami. Vytvorený elektrónový pár patrí dvom atómom rovnako.
- Počet väzieb vytvorených jedným alebo druhým atómom sa rovná počtu nespárovaných elektrónov v základnom a excitovanom stave.
- Ak sa elektronické páry nezúčastňujú na vytváraní väzby, potom sa nazývajú osamelé páry.
Elektronegativita
Je možné určiť typ chemickej väzby v látkach na základe rozdielu v hodnotách elektronegativít ich základných atómov. Pod elektronegativita pochopiť schopnosť atómov odtrhávať spoločné elektrónové páry (elektrónový oblak), čo vedie k polarizácii väzby.
Existujú rôzne spôsoby, ako definovať hodnotyelektronegativity chemických prvkov. Najpoužívanejšia je však stupnica založená na termodynamických údajoch, ktorú navrhol ešte v roku 1932 L. Pauling.

Čím väčší je rozdiel velektronegativita atómov, tým viac sa prejavuje jeho iónovosť. Naopak, rovnaké alebo blízke hodnoty elektronegativity naznačujú kovalentnú povahu väzby. Inými slovami, je možné matematicky určiť, aký druh chemickej väzby je pozorovaný v konkrétnej molekule. Aby ste to dosiahli, musíte vypočítať ΔХ - rozdiel medzi elektronegativitami atómov podľa vzorca: ΔX = | X1-NS2|.
- Ak ΔX> 1,7, potom je väzba iónová.
- Ak 0,5≤ΔX≤1,7, potom je kovalentná väzba polárna.
- Ak ΔX = 0 alebo blízko nej, potom väzba označuje kovalentnú nepolárnu.
Iónová väzba
Iónové je spojenie, ktoré sa objavujemedzi iónmi alebo v dôsledku úplného stiahnutia spoločného elektrónového páru jedným z atómov. V látkach sa tento typ chemickej väzby uskutočňuje silami elektrostatickej príťažlivosti.
Ióny sú nabité častice vytvorené zatómov v dôsledku pripojenia alebo uvoľnenia elektrónov. Ak atóm prijme elektróny, získa záporný náboj a stane sa aniónom. Ak atóm daruje valenčné elektróny, stáva sa kladne nabitou časticou nazývanou katión.
Je charakteristická pre zlúčeniny vznikajúce priinterakcia atómov typických kovov s atómami typických nekovov. Hlavnou súčasťou tohto procesu je túžba atómov získať stabilné elektronické konfigurácie. A typické kovy a nekovy na to potrebujú dať alebo prijať iba 1-2 elektróny, čo sa im ľahko podarí.

Mechanizmus vzniku iónovej chemickej väzby vmolekula sa tradične uvažuje na príklade interakcie sodíka a chlóru. Atómy alkalických kovov ľahko darujú elektrón ťahaný atómom halogénu. V dôsledku toho sa vytvorí katión Na+ a anión Cl-ktoré drží pohromade elektrostatická príťažlivosť.
Ideálna iónová väzba neexistuje.Ani v takýchto zlúčeninách, ktoré sa často označujú ako iónové, nedochádza ku konečnému prechodu elektrónov z atómu na atóm. Vytvorený elektrónový pár sa stále bežne používa. Preto sa hovorí o stupni ionicity kovalentnej väzby.
Iónová väzba sa vyznačuje dvoma hlavnými navzájom súvisiacimi vlastnosťami:
- nesmerovosť, to znamená, že elektrické pole okolo iónu má tvar gule;
- nenasýtenosť, teda počet opačne nabitých iónov, ktoré sa môžu nachádzať okolo akéhokoľvek iónu, je určený ich veľkosťou.
Kovalentná chemická väzba
Väzba vytvorená prekrývaním elektronikyoblaky atómov nekovov, to znamená, že sa uskutočňujú spoločným elektrónovým párom, sa nazýva kovalentná väzba. Počet zdieľaných párov elektrónov určuje multiplicitu väzby. Atómy vodíka sú teda spojené jednou väzbou H · H a atómy kyslíka tvoria dvojitú väzbu O :: O.
Existujú dva mechanizmy jeho vzniku:
- Vymeniteľné – každý atóm predstavuje prevznik spoločného páru jedného elektrónu: А
- Donor-akceptor - na vytvorenie väzby jeden z atómov (donor) poskytuje pár elektrónov a druhý (akceptor) poskytuje voľný orbitál na jeho umiestnenie: A +: B = A: B.

Rozdielne sú aj spôsoby prekrývania elektrónových oblakov pri tvorbe kovalentnej chemickej väzby.
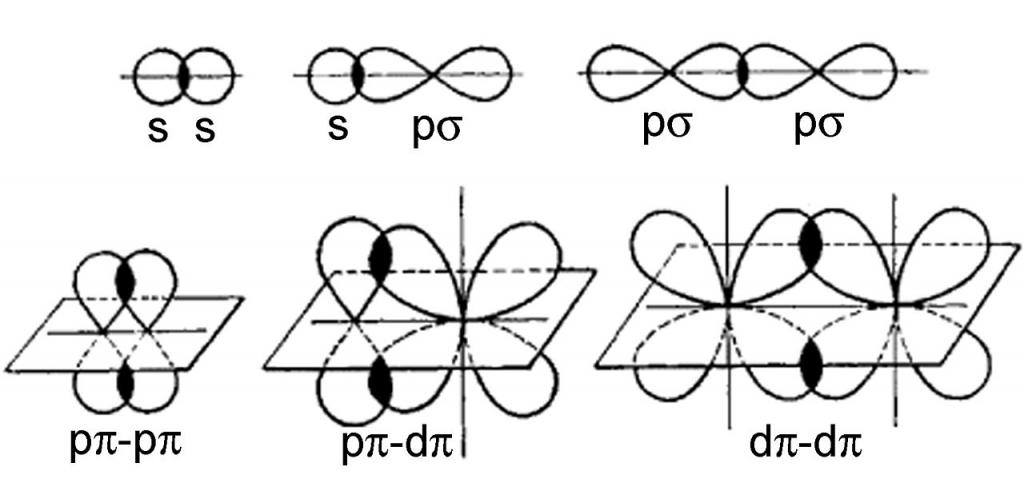
- Priamy.Oblasť prekrytia oblakov leží na priamke pomyselnej čiary spájajúcej jadrá uvažovaných atómov. V tomto prípade vznikajú σ-väzby. Typ chemickej väzby, ktorá sa v tomto prípade vyskytuje, závisí od typu elektrónových oblakov, ktoré sa prekrývajú: s-s, s-p, p-p, s-d alebo p-d σ-väzby. V častici (molekule alebo ióne) je možná iba jedna σ-väzba medzi dvoma susednými atómami.
- Bočné.Vykonáva sa na oboch stranách čiary spájajúcej atómové jadrá. Takto vzniká π-väzba a možné sú aj jej varianty: p-p, p-d, d-d. Okrem σ-väzby sa π-väzba nikdy nevytvorí, môže byť v molekulách obsahujúcich viacnásobné (dvojité a trojité) väzby.
Vlastnosti kovalentnej väzby
Práve oni určujú chemické a fyzikálnevlastnosti spojov. Hlavnými vlastnosťami akejkoľvek chemickej väzby v látkach sú jej smerovosť, polarita a polarizovateľnosť, ako aj sýtosť.
Zamerajte sa spojenie je spôsobené zvláštnosťami molekulštruktúra látok a geometrický tvar ich molekúl. Jej podstatou je, že najlepšie prekrytie elektrónových oblakov je možné pri určitej orientácii v priestore. Varianty tvorby σ- a π-väzieb už boli zvážené vyššie.
pod nasýtenia pochopiť schopnosť atómov vytvárať určitý počet chemických väzieb v molekule. Počet kovalentných väzieb pre každý atóm je obmedzený počtom vonkajších orbitálov.
Polarita spojenie závisí od rozdielu hodnôtelektronegativity atómov. Od toho závisí rovnomernosť rozloženia elektrónov medzi jadrami atómov. Kovalentná väzba pre túto vlastnosť môže byť polárna alebo nepolárna.
- Ak spoločný elektrónový pár patrí rovnako ku každému z atómov a nachádza sa v rovnakej vzdialenosti od ich jadier, potom je kovalentná väzba nepolárna.
- Ak sa spoločný pár elektrónov presunie do jadra jedného z atómov, vytvorí sa kovalentná polárna chemická väzba.
Polarizovateľnosť sa vyjadruje vytesnením väzbových elektrónov podpôsobenie vonkajšieho elektrického poľa, ktoré môže patriť inej častici, susedným väzbám v tej istej molekule alebo pochádzať z vonkajších zdrojov elektromagnetických polí. Takže kovalentná väzba pod ich vplyvom môže zmeniť svoju polaritu.
Hybridizáciou orbitálov sa rozumie zmena ich tvaru pri realizácii chemickej väzby. Je to potrebné na dosiahnutie čo najefektívnejšieho prekrývania. Existujú nasledujúce typy hybridizácie:
- sp3... Jeden s a tri p orbitály tvoria štyri „hybridné“ orbitály rovnakého tvaru. Navonok sa podobá štvorstenu s uhlom medzi osami 109 °.
- sp2... Jeden s- a dva p-orbitály tvoria plochý trojuholník s uhlom medzi osami 120°.
- sp. Jeden s- a jeden p-orbitál tvoria dva "hybridné" orbitály s uhlom medzi ich osami 180°.
Kovová väzba
Charakteristickým znakom štruktúry atómov kovov jepomerne veľký polomer a prítomnosť malého počtu elektrónov vo vonkajších orbitáloch. Výsledkom je, že v takýchto chemických prvkoch je väzba medzi jadrom a valenčnými elektrónmi relatívne slabá a ľahko sa rozbije.
Kovové väzba sa nazýva taká interakcia medzi atómami-iónmi kovov, ktorá sa uskutočňuje pomocou delokalizovaných elektrónov.
V kovových časticiach môžu valenčné elektrónyje ľahké opustiť vonkajšie orbitály, ako aj obsadiť na nich voľné miesta. V rôznych časoch teda tá istá častica môže byť atómom a iónom. Elektróny z nich oddelené sa voľne pohybujú po celom objeme kryštálovej mriežky a uskutočňujú chemickú väzbu.

Tento typ väzby má podobnosti s iónovými akovalentný. Pokiaľ ide o iónovú väzbu, na existenciu kovovej väzby sú potrebné ióny. Ak sú však na realizáciu elektrostatickej interakcie v prvom prípade potrebné katióny a anióny, potom v druhom prípade zohrávajú úlohu záporne nabitých častíc elektróny. Ak porovnáme kovovú väzbu s kovalentnou väzbou, na vytvorenie oboch sú potrebné spoločné elektróny. Na rozdiel od polárnej chemickej väzby však nie sú lokalizované medzi dvoma atómami, ale patria všetkým kovovým časticiam v kryštálovej mriežke.
Špeciálne vlastnosti takmer všetkých kovov sú spôsobené kovovou väzbou:
- plasticita, je prítomná v dôsledku možnosti premiestnenia vrstiev atómov v kryštálovej mriežke, držanej elektrónovým plynom;
- kovový lesk, ktorý sa pozoruje v dôsledku odrazu svetelných lúčov od elektrónov (v práškovom stave neexistuje žiadna kryštálová mriežka, a preto sa pozdĺž nej pohybujú elektróny);
- elektrická vodivosť, ktorá sa uskutočňuje prúdom nabitých častíc a v tomto prípade sa malé elektróny voľne pohybujú medzi veľkými kovovými iónmi;
- tepelná vodivosť, pozorovaná vďaka schopnosti elektrónov prenášať teplo.
Vodíková väzba
Tento typ chemickej väzby sa niekedy nazývamedzistupeň medzi kovalentnými a intermolekulárnymi interakciami. Ak má atóm vodíka väzbu s jedným zo silne elektronegatívnych prvkov (ako je fosfor, kyslík, chlór, dusík), potom je schopný vytvoriť ďalšiu väzbu nazývanú vodík.
Je oveľa slabšia ako všetky vyššie uvedené typy väzieb (energia nie viac ako 40 kJ / mol), ale nemožno ju zanedbať. To je dôvod, prečo vodíková chemická väzba v diagrame vyzerá ako bodkovaná čiara.

Tvorba vodíkovej väzby je možná v dôsledkudonor-akceptor elektrostatická interakcia súčasne. Veľký rozdiel v hodnotách elektronegativity vedie k vzniku nadmernej hustoty elektrónov na atómoch O, N, F a ďalších, ako aj k jej nedostatku na atóme vodíka. V prípade, že medzi takýmito atómami neexistuje chemická väzba, ak sú dostatočne blízko, aktivujú sa príťažlivé sily. V tomto prípade je protón akceptorom elektrónového páru a druhý atóm je donor.
Vodíková väzba sa môže vyskytovať medzi susednými molekulami, napríklad vodou, karboxylovými kyselinami, alkoholmi, amoniakom, ako aj v rámci molekuly, napríklad kyselinou salicylovou.
Prítomnosť vodíkovej väzby medzi molekulami vody vysvetľuje množstvo jej jedinečných fyzikálnych vlastností:
- Hodnoty jeho tepelnej kapacity, dielektrikapermeabilita, body varu a topenia by mali byť v súlade s výpočtami výrazne nižšie ako tie skutočné, čo sa vysvetľuje konektivitou molekúl a potrebou vynaložiť energiu na prerušenie medzimolekulových vodíkových väzieb.
- Na rozdiel od iných látok pri znižovaníteplote sa objem vody zväčšuje. Je to spôsobené tým, že molekuly zaujímajú určitú polohu v kryštálovej štruktúre ľadu a vzďaľujú sa od seba o dĺžku vodíkovej väzby.
Toto spojenie zohráva osobitnú úlohu pre živých.organizmov, pretože jeho prítomnosť v molekulách bielkovín určuje ich špeciálnu štruktúru, a teda vlastnosti. Okrem toho sú nukleové kyseliny, ktoré tvoria dvojitú špirálu DNA, tiež spojené vodíkovými väzbami.
Kryštálové väzby
Prevažná väčšina pevných látok mákryštálová mriežka - špeciálne vzájomné usporiadanie častíc, ktoré ich tvoria. V tomto prípade sa pozoruje trojrozmerná periodicita a atómy, molekuly alebo ióny sa nachádzajú v uzloch, ktoré sú spojené imaginárnymi čiarami. V závislosti od povahy týchto častíc a väzieb medzi nimi sa všetky kryštálové štruktúry delia na atómové, molekulárne, iónové a kovové.
Miesta mriežky iónových kryštálov súkatiónov a aniónov. Navyše, každý z nich je obklopený presne definovaným počtom iónov len s opačným nábojom. Typickým príkladom je chlorid sodný (NaCl). Majú tendenciu mať vysoké teploty topenia a tvrdosť, pretože vyžadujú veľa energie na rozbitie.
Na miestach molekulárnej kryštálovej mriežky sú molekuly látok tvorené kovalentnou väzbou (napríklad I2). Sú navzájom prepojené slabou van der Waalsovou interakciou, a preto sa takáto štruktúra ľahko zničí. Takéto zlúčeniny majú nízke teploty varu a topenia.
Atómovú kryštálovú mriežku tvoria atómychemické prvky s vysokými valenčnými hodnotami. Sú spojené silnými kovalentnými väzbami, čo znamená, že látky majú vysoké teploty varu, topenia a veľkú tvrdosť. Príkladom je diamant.
Všetky typy odkazov dostupné vchemikálie majú svoje vlastné charakteristiky, ktoré vysvetľujú jemnosť interakcie častíc v molekulách a látkach. Vlastnosti spojov závisia od nich. Určujú všetky procesy prebiehajúce v prostredí.








