Gazul, cum ar fi ozonul, este extrem de valoros pentru întreaga omenire. Elementul chimic prin care se formează este oxigenul O. De fapt, ozonul este O3 - una dintre modificările alotrope ale oxigenului,constând din trei unități de formule (O ÷ O ÷ O). Primul și mai bine cunoscut compus este oxigenul în sine, mai exact un gaz care este format din cei doi atomi (O = O) -02.

Allotropia este capacitatea unei substanțe chimiceelement pentru a forma un număr de proprietăți diferite ale compușilor simpli. Datorită ei, omenirea a studiat și folosește substanțe precum diamantul și grafitul, sulful monoclinic și rombic, oxigenul și ozonul. Elementul chimic care are această abilitate nu este neapărat limitat la doar două modificări, unele dintre ele având mai multe.
Istoricul deschiderii conexiunii
Unitatea constitutivă a multor organice șisubstanțe minerale, cum ar fi ozonul - un element chimic, denumirea căruia este oxigenul O, tradus din "oxys" grecesc - acru și "gignomai" - pentru a da naștere.

Впервые новую аллотропную модификацию кислорода în timpul experimentelor cu evacuări electrice, olandezul Martin van Maroon descoperit în 1785, atenția lui a fost atrasă de un miros specific. Un secol mai târziu, francezul Shenbane a remarcat prezența aceluiași după o furtună, astfel încât gazul a fost numit "miros". Dar oamenii de știință au fost oarecum înșelați, având în vedere că mirosul lor miroase mirosul de ozon. Mirosul pe care ei îl simțeau aparținea compușilor organici oxidați atunci când interacționează cu O3deoarece gazul este foarte reactiv.
Structura electronică
O2 și O3 au același fragment structural.- element chimic. Ozonul are o structură mai complexă. Oxigenul este încă simplu - doi atomi cu oxigen unite printr-o legătură dublă și care constau din ϭ- π-component, în funcție de valența elementului. oh3 are mai multe structuri rezonante.
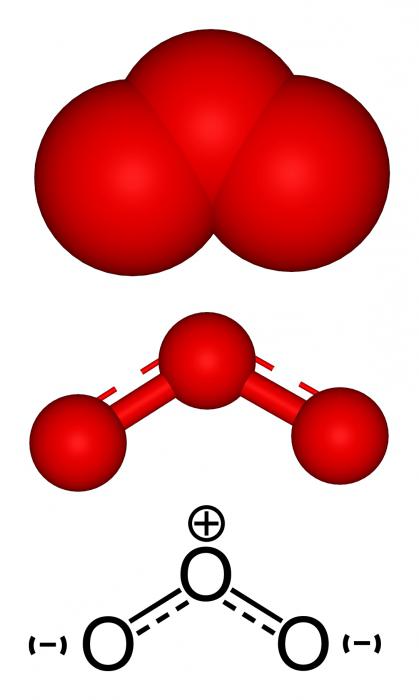
Metode de sinteză
Pentru formarea unui astfel de gaz ca ozonul, elementul chimic oxigen trebuie să fie într-un mediu gazos sub formă de atomi individuali. Astfel de condiții sunt create atunci când moleculele de oxigen se ciocnesc.2 cu electroni în timpul evacuărilor electrice sau a altor particule cu energie înaltă, precum și în timpul iradierii cu lumină ultravioletă.
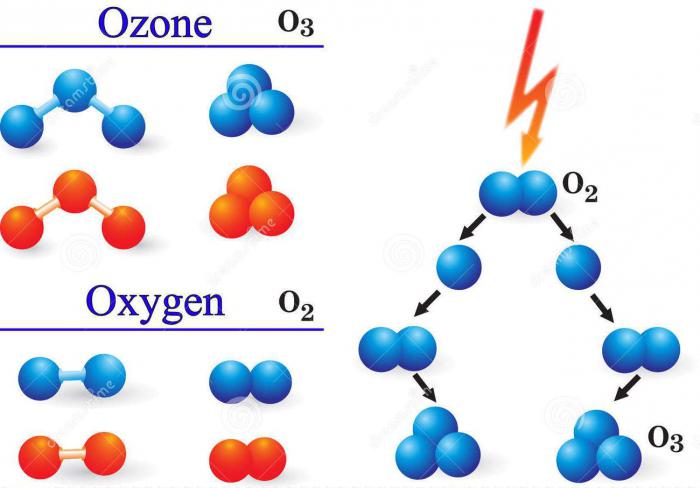
Cota leului din ozon total încondițiile naturale ale atmosferei se formează prin metoda fotochimică. Omul preferă să utilizeze alte metode în activitatea chimică, cum ar fi, de exemplu, sinteza electrolitică. Aceasta constă în faptul că electrozii de platină sunt plasați în mediul apos electrolitic și încep să curgă curentul. Schema de reacție:
H2O + O2 → Despre3 + N2 + e-
Proprietăți fizice
Oxigenul (O) este o unitate constitutivă a unei substanțe, cum ar fi ozonul, un element chimic al cărui formulă, precum și masa molară relativă, sunt indicate în tabelul periodic. Formarea o3, oxigenul obține proprietăți care sunt radical diferite de proprietățile lui O2.

Gazul albastru este starea obișnuităcompuși cum ar fi ozonul. Elementul chimic, formula, caracteristicile cantitative - toate acestea sunt determinate în identificarea și studiul acestei substanțe. Punctul de fierbere pentru aceasta este -111.9 ° C, starea lichefiată are o culoare violet închisă, cu scăderea în continuare a temperaturii la -197.2 ° C, începe topirea. În stare solidă, ozonul dobândește o culoare neagră cu o nuanță violetă. Solubilitatea acestuia este de zece ori mai mare decât această proprietate a oxigenului.2. Cu cele mai mici concentrații în aer, mirosul de ozon este simțit, este aspru, specific și seamănă cu mirosul de metal.
Proprietăți chimice
Очень активным, с реакционной точки зрения, este gazul de ozon. Elementul chimic care îl formează este oxigenul. Caracteristicile care determină comportamentul ozonului în interacțiunea cu alte substanțe sunt capacitatea ridicată de oxidare și instabilitatea gazului în sine. La temperaturi ridicate se descompune într-un ritm fără precedent și procesul este accelerat de catalizatori, cum ar fi oxizi de metale, clor, dioxid de azot și altele. Proprietățile agentului de oxidare sunt inerente în ozon datorită particularităților structurii moleculei și mobilității unuia dintre atomii de oxigen, care se separă, transformă gazul în oxigen: O3 → Despre2 + Despre ·
Оксиген (кирпичик, из которого построены молекулы substanțe cum ar fi oxigenul și ozonul) - un element chimic. Așa cum este scris în ecuațiile de reacție - O ·. Ozonul oxidează toate metalele, cu excepția aurului, a platinei și a subgrupurilor sale. Reacționează cu gazele din atmosferă - oxizi de sulf, azot și altele. Substanțele organice nu rămân inerte, în special procedeele de rupere a legăturilor multiple continuă prin formarea de compuși intermediari. Este imperativ ca produsele reacțiilor să fie inofensive pentru mediu și oameni. Acestea sunt apa, oxigenul, oxizii mai mari ai diferitelor elemente, oxizi de carbon. Compuși binari de calciu, titan și siliciu cu oxigen nu intră în interacțiune cu ozonul.

cerere
Zona principală în care se utilizează gaz mirositor.- aceasta este ozonarea. Această metodă de sterilizare este mult mai eficientă și mai sigură pentru organismele vii decât dezinfecția cu clor. În timpul purificării apei cu ozon, nu se produce formarea derivaților de metan toxici înlocuiți cu halogen periculos.
Din ce în ce mai mult, această metodă ecologică de sterilizarese găsește în industria alimentară. Echipamente de refrigerare cu proces de ozon, camere de depozitare pentru produse, cu ajutorul lui petrec eliminarea mirosurilor.
Pentru medicamente, proprietățile dezinfectante ale ozonului sunt, de asemenea, indispensabile. Acestea sunt dezinfectate prin răni, soluții fiziologice. O serie de boli cronice sunt tratate cu ozon de sânge venos, precum și cu un "miros" de gaze.
Fiind în natură și înțeles
Ozonul simplu de substanță - un element al compoziției gazuluistratosfera, regiunea spațiului apropiat de Pământ, situată la o distanță de aproximativ 20-30 km de suprafața planetei. Izolarea acestui compus are loc în timpul proceselor asociate cu evacuările electrice, în timpul sudării și în funcționarea aparatului Xerox. Dar în stratosfera se formează și se află 99% din cantitatea totală de ozon din atmosfera Pământului.
Vital a fost prezența gazului înspațiul apropiat de pământ. Formează în el așa-numitul strat de ozon, care protejează toată viața de radiația ultravioletă fatală a soarelui. Ciudat cum pare, dar la fel ca avantajele imense, gazul în sine este periculos pentru oameni. Creșterea concentrației de ozon în aer pe care o persoană o respiră este dăunătoare organismului datorită activității sale chimice extreme.









