Co to jest termodynamika?Jest to gałąź fizyki, która bada właściwości układów makroskopowych. Jednocześnie badane są również metody przetwarzania energii i metody jej przesyłania. Termodynamika to gałąź fizyki, która bada procesy zachodzące w układach i ich stanach. Dziś porozmawiamy o tym, co jeszcze znajduje się na liście rzeczy, które studiuje.
Definicja
Na poniższym zdjęciu można zobaczyć przykład termogramu uzyskanego podczas badania dzbanka z gorącą wodą.
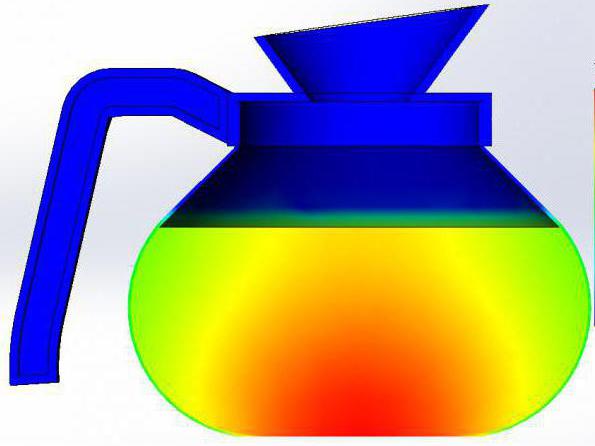
Termodynamika to nauka, na której się opierauogólnione fakty uzyskane eksperymentalnie. Procesy zachodzące w układach termodynamicznych opisano za pomocą wielkości makroskopowych. Ich lista zawiera parametry takie jak stężenie, ciśnienie, temperatura i tym podobne. Oczywiste jest, że nie mają one zastosowania do poszczególnych cząsteczek, ale sprowadzają się do opisu układu w jego ogólnej formie (w przeciwieństwie do tych ilości, które są stosowane na przykład w elektrodynamice).
Termodynamika to także gałąź fizykiMa swoje własne prawa. Podobnie jak reszta mają charakter ogólny. Konkretne szczegóły struktury jednej lub drugiej wybranej przez nas substancji nie będą miały znaczącego wpływu na naturę praw. Dlatego twierdzą, że ta gałąź fizyki jest jedną z najbardziej odpowiednich (lub raczej skutecznie stosowanych) w nauce i technologii.
Aplikacja

Przykłady można wymieniać bardzo długo.Na przykład wiele rozwiązań opartych na prawach termodynamicznych można znaleźć w dziedzinie inżynierii cieplnej lub energii elektrycznej. Co możemy powiedzieć o opisie i zrozumieniu reakcji chemicznych, przemian fazowych, zjawisk transportowych. W pewien sposób termodynamika „współpracuje” z dynamiką kwantową. Zakres ich kontaktu to opis zjawiska czarnych dziur.
Prawa

Powyższy rysunek pokazuje istotę jednego z procesów termodynamicznych - konwekcji. Ciepłe warstwy substancji wznoszą się, a zimno - opadają.
Alternatywna nazwa prawa, która, nawiasem mówiąc,nieużywany jako przykład częściej, jest początkiem termodynamiki. Do tej pory są trzy z nich (plus jedno „zero” lub „wspólne”). Zanim jednak porozmawiamy o tym, co implikuje każde z tych praw, spróbujmy odpowiedzieć na pytanie, jakie są początki termodynamiki.
Są zbiorem pewnychpostulaty, które są podstawą zrozumienia procesów zachodzących w makrosystemach. Zasady termodynamiki zostały ustalone empirycznie w trakcie całej serii eksperymentów i badań naukowych. Tak więc istnieją dowody, które pozwalają nam przyjąć postulaty do służby bez najmniejszej wątpliwości co do ich trafności.
Niektórzy zastanawiają się, dlaczegotermodynamika potrzebuje tych właśnie praw. Cóż, możemy powiedzieć, że potrzeba ich użycia wynika z faktu, że w tej części fizyki parametry makroskopowe są opisane w sposób ogólny, bez żadnej wzmianki o ich mikroskopijnym charakterze lub cechach tego samego planu. To nie jest sfera termodynamiki, ale fizyki statystycznej, by być bardziej szczegółowym. Inną ważną rzeczą jest fakt, że początki termodynamiki są od siebie niezależne. Oznacza to, że nie można wydedukować jednej z drugich.
Aplikacja

Применение термодинамики, как было сказано ранее, idzie w wielu kierunkach. Nawiasem mówiąc, jedna z jego zasad jest przyjęta przy okazji, co inaczej jest interpretowane w postaci prawa zachowania energii. Rozwiązania i postulaty termodynamiczne są z powodzeniem wdrażane w branżach takich jak energetyka, biomedycyna, chemia. Tutaj w energii biologicznej powszechnie stosuje się prawo zachowania energii oraz prawo prawdopodobieństwa i kierunku procesu termodynamicznego. Oprócz tego wykorzystywane są trzy najczęstsze koncepcje, na których opiera się cała praca i jej opis. Jest to układ termodynamiczny, proces i faza procesu.
Procesy
Procesy w termodynamice mają różny stopieńtrudności. Jest ich siedem. Generalnie w tym przypadku proces należy rozumieć jako nic innego jak zmiana makroskopowego stanu, do którego system został doprowadzony wcześniej. Należy rozumieć, że różnica między warunkowym stanem początkowym a końcowym wynikiem może być pomijalna.
Jeśli różnica jest nieskończenie mała, to co się stałomożemy ten proces nazwać elementarnym. Jeśli mamy zamiar omawiać procesy, będziemy musieli uciec się do podania dodatkowych warunków. Jednym z nich jest „ciało robocze”. Płyn roboczy to układ, w którym zachodzi jeden lub kilka procesów termicznych.
Procesy są tradycyjnie podzielone na nierównowagęi wyważone. W tym ostatnim przypadku wszystkie stany, przez które musi przejść układ termodynamiczny, są odpowiednio nierównowagą. Często zmiana stanu następuje w takich przypadkach w szybkim tempie. Ale procesy równowagi są bliskie quasi-statycznym. Zmiany w nich są o rząd wielkości wolniejsze.
Procesy termiczne zachodzące wsystemy termodynamiczne mogą być zarówno odwracalne, jak i nieodwracalne. Aby zrozumieć istotę, podzielimy sekwencję działań w naszej reprezentacji na określone przedziały. Jeśli możemy wykonać ten sam proces w przeciwnym kierunku z tymi samymi „stacjami pośrednimi”, to można go nazwać odwracalnym. W przeciwnym razie to nie zadziała.








