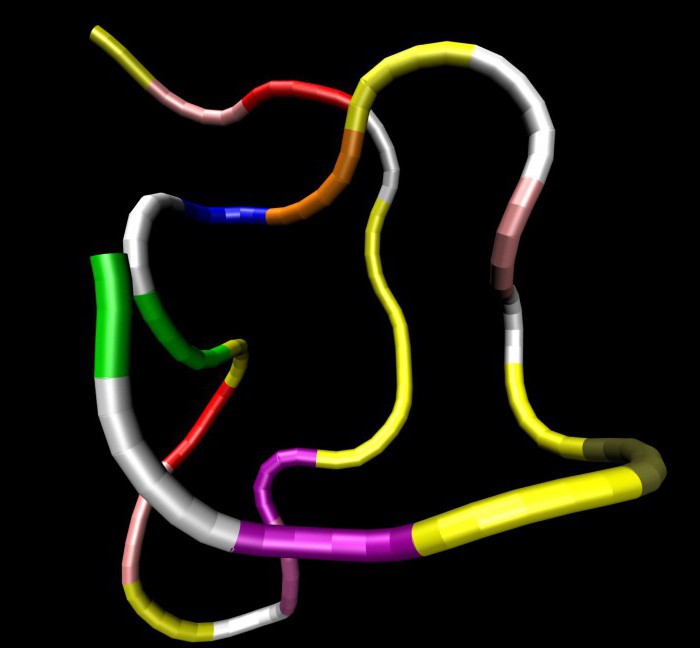
Molekulės yra sudarytos iš aminorūgščių liekanųbaltymai. Tokie polimerai yra didelės molekulinės masės natūralios medžiagos. Jie apima tokius cheminius elementus kaip anglis, juose yra vandenilio, deguonies atomų ir yra azoto. Nukleino rūgštyse yra fosforo, o daugelyje baltymų yra sieros.

Konstrukcinės savybės
Kadangi susidaro aminorūgščių liekanosbaltymų molekulių molekulių, jos turi didelę santykinę molekulinę masę. Jie vadinami makropolimerais. Mažos molekulinės masės junginių pavyzdžiai yra alkoholiai, karboksirūgštys, nukleotidai, monosacharidai, aminorūgštys.

Makromolekulės
Būtent iš aminorūgščių liekanųbaltymų molekulės, būtinos gyvų organizmų gyvenimui. Vidutiniškai jų santykinė molekulinė masė svyruoja nuo kelių tūkstančių iki milijono. Baltymų junginių, nukleorūgščių, polisacharidų molekulėse daroma prielaida, kad kartojasi vienetai.
Monomerai yra paprastos molekulės, kuriosyra polimero molekulės susidarymo pagrindas. Kokios molekulės yra pastatytos iš aminorūgščių liekanų? Atsakymas į šį klausimą yra žinomas kiekvienam gimnazistui. Aminorūgštys jiems veikia kaip monomerai. Polisacharidams reikalingi monosacharidai, o nukleotidams - nukleorūgštys.

Biopolimerų vertė
Taigi, iš aminorūgščių liekanų susidarobaltymų molekulės, atliekančios kelias funkcijas vienu metu. Reikėtų atkreipti dėmesį į jų kūrimo funkciją. Tai leidžia jums sukurti baltymų molekules, būdingas atskiram gyvam organizmui. Be to, baltymų molekulės yra energijos šaltinis, todėl baltymai įtraukiami į dienos racioną. Ląstelėse yra skirtingi organinių junginių kiekiai. Pavyzdžiui, gyvūnams būdingas lipidų ir baltymų vyravimas, o augaluose - pakankamas angliavandenių kiekis.
Molekulės yra sudarytos iš aminorūgščių liekanųgyvūniniai baltymai. Šie „statybiniai blokai“, kurie yra amfoteriniai cheminiai junginiai, yra pastatyti baltymų molekulėje tam tikra seka. Šiuo metu yra informacijos apie dviejų šimtų aminorūgščių egzistavimą, tačiau tik dvidešimt jų naudojamos natūraliems baltymams formuoti. Paprastai jie vadinami baltymus formuojančiais. Pavyzdžiui, baltymai gali būti sukonstruoti keičiant alaniną, leuciną, liziną, asparto rūgštį, valiną, metioniną, glutaminą, treoniną. Paklausti, kurios molekulės yra sudarytos iš aminorūgščių liekanų, moksleiviai pateikia gyvūninių baltymų pavyzdžius.

Cheminės struktūros ypatybės
Aminorūgštyse, kurios sugeba susidarytimakromolekulės, amino grupė ir karboksilo grupė yra sujungtos su vienu anglies atomu. Būtent ši funkcija sujungia minėtą skaičių. Amino rūgšties liekanos skiriasi radikalo sudėtimi. Tai gali būti hidrofilinė arba hidrofobinė, polinė arba nepolinė, o tai suteikia specifinių aminorūgščių savybių.
Didžioji dalis amino rūgščių, galinčių susidarytibaltymo molekulių, turi vieną karboksilo grupę (joje yra hidroksilo ir karbonilo) ir vieną amino grupę, todėl jos laikomos neutraliomis molekulėmis.
Taip pat yra bazinių amino rūgščių, turinčių kelias amino grupes vienu metu, taip pat rūgščių amino rūgščių, turinčių kelias karboksilo grupes. Pavyzdžiui, cisteino molekulėje yra sieros atomų.
Sintezės variantai
Autotrofiniai organizmai aminorūgštis sintetina iš azoto turinčių neorganinių medžiagų, taip pat iš fotosintezės produktų.
Heterotrofiniai organizmai naudojami kaippagrindinis aminorūgščių šaltinis yra maistas. Žmogaus organizme kai kurios amino rūgštys sintetinamos iš medžiagų apykaitos produktų. Tokie junginiai laikomi keičiamais. Tam tikri maisto produktai yra naudojami kaip būtinų amino rūgščių, kurių negalima sintetinti žmogaus organizme, šaltinis. Kokios rūgštys vadinamos būtinomis žmonėms? Tai yra lizinas, fenilalaninas, leucinas, valinas, izoleucinas, triptofanas, metioninas. Vaiko organizmui yra dar dvi nepakeičiamos amino rūgštys: histidinas ir argininas.
Kadangi aminorūgštys yra amfoterinėsjunginiai, jie yra labai reaktyvūs. Tarp vienos rūgšties amino grupės ir antrosios molekulės karboksilo grupės susidaro cheminis ryšys, vadinamas peptidiniu (amido) ryšiu.
Dėl panašios cheminės reakcijossusidaro linijinė peptido struktūra. Vienas naujojo junginio galas turi aminogrupę, o kitas - laisvąją karboksilo grupę. Ši struktūra leidžia dipeptidui sąveikauti su kitomis aminorūgščių molekulėmis ir sudaryti polipeptidinius junginius.
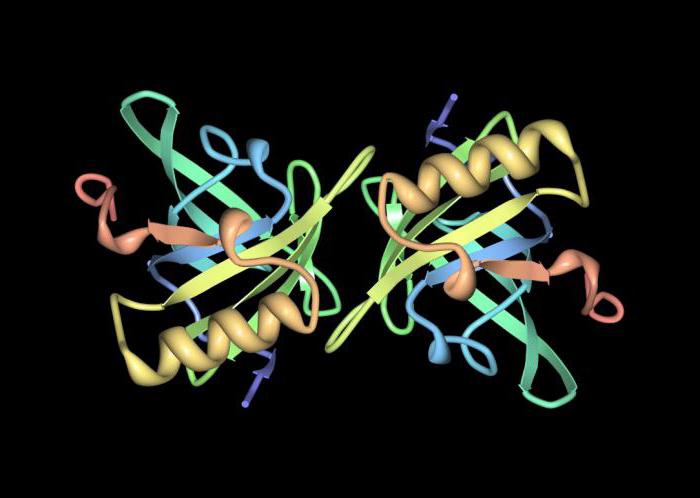
Išvada
Peptidai yra ypač svarbūsžmogaus gyvenimas. Jų struktūroje esantys polipeptidai yra toksinai, antibiotikai ir kai kurie hormonai. Polipeptidinėse grandinėse gali būti tūkstančiai aminorūgščių liekanų, išdėstytų tam tikra seka. Jei baltymų makromolekulėse yra tik aminorūgščių liekanos, jos vadinamos paprastomis.
Jei baltymo molekulės struktūroje yra ne tikaminorūgščių komponentai, bet taip pat geležies, mangano, cinko, cukraus, nukleotidų, lipidų katijonai, tokiu atveju molekulės vadinamos kompleksiniais baltymais. Mes išskiriame fibriną, kraujo albuminą ir fermentus kaip paprastus paprastus baltymus.
Antikūnai laikomi kompleksinėmis baltymų molekulėmis(imunoglobulinai), fermentai. Yra keturi baltymo molekulių struktūrinio organizavimo tipai. Pagrindinė struktūra yra linijinė aminorūgščių liekanų seka, sujungta peptidiniais (amidiniais) ryšiais.
Tai ji nustato funkcijas, savybes ir taip patbaltymų forma. Pirminės struktūros pagrindu kuriami kiti struktūrų variantai. Kiekvienas organizmas turi savo unikalią pirminę struktūrą, kuri sukelia tam tikras sintezės problemas. Pavyzdžiui, kyla problemų renkantis vaistus konkretiems žmonėms.