Metanas ir jo homologai vadinami marginalais(sotieji) parafino angliavandeniliai arba alkanai. Pastarasis pavadinimas organinėms medžiagoms (kurių bendra cheminė formulė CnH2n + 2, atspindintis molekulių, kurių atomai yra susieti paprastais anglies - vandenilio arba anglies - anglies kovalentiniais ryšiais, prisotinimas) priskiriamas pagal tarptautinę cheminių junginių nomenklatūrą. Jie turi du pagrindinius šaltinius: žalios naftos ir gamtinių dujų. Alkanų savybės homologinėse serijose su anglies atomų skaičiaus padidėjimu molekulėje nuolat keičiasi.
Pirmieji keturi homologinių serijų atstovaituri istoriškai nustatytų vardų. Už jų esančios angliavandeniliai žymimi graikų skaičiais, kurių pabaigoje -an. Kiekvieno sekančio angliavandenilio santykinė molekulinė masė skiriasi nuo ankstesnio 14 amu. Fakcin ÷ s alkanų savyb ÷ s, tokios kaip lydymosi temperatūra (įpylimo taškas) ir virimo temperatūra (kondensacija), tankis ir lūžio rodiklis, did ÷ ja, didinant molekulinę masę. Nuo metano iki butano yra dujos: nuo pentano iki pentadekano yra skysčiai, o po to - kietos medžiagos. Visi parafinai yra lengvesni už vandenį ir neištirpinami. Alkanai apima:
- CH4 yra metanas;
- C2H6 - etanas;
- C3H8 - propanas;
- C4H10 - butanas;
- C5H12 - pentanas;
- C6H14-heksanas;
- C7H16 - heptanas;
- C8H18 yra oktanas;
- C9H20 - nonanas;
- C10H22 - dekanas;
- C11H24 yra undekanas;
- C12H26 - dodekanas;
- C13H28 - tridekanas;
- C14H30 - tetradekanas;
- C15H32 - pentadekanas;
- C16H34 - heksadekanas;
- C17H36 - heptadekanas;
- C18H38 yra oktadekanas;
- C19H40 - nonadekanas;
- C20H42 - eikozanas ir pan.
Cheminės alkanų savybės yra mažosveikla. Taip yra dėl to, kad C-C ir mažai poliarinių C-H ryšių santykis yra stiprus, taip pat dėl molekulių prisotinimo. Visi atomai yra jungiami atskirais σ-ryšiais, kuriuos sunku sunaikinti dėl mažo poliarizacijos. Jų plyšimas gali būti realizuojamas tik esant tam tikroms sąlygoms, ir susidaro radikalai, kurie pavadinti atitinkamų parafininių junginių pavadinimu, pakeičiant galą. Pavyzdžiui, propanas yra propilas (C3H7–), etanas yra etilas (C2H5–), metanas yra metilas (CH3–) ir pan.
Alkanų cheminės savybės kalba apie inertiškumąšių junginių. Jie nesugeba papildyti reakcijų. Jiems būdingos pakaitinės reakcijos. Parafininių angliavandenilių oksidacija (deginimas) vyksta tik esant aukštai temperatūrai. Jie gali būti oksiduoti alkoholiais, aldehidais ir rūgštimis. Dėl krekingo (angliavandenilių terminio skilimo proceso) 450-450 ° C temperatūroje gali susidaryti mažesnės molekulinės masės sočiųjų angliavandenilių. Didėjant temperatūrai, terminis skilimas vadinamas pirolize.
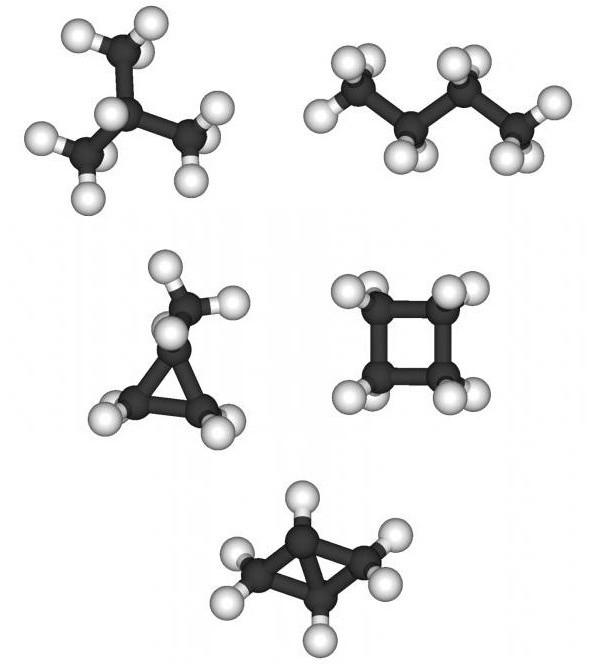
Alkanų cheminės savybės priklauso ne tik nuoskaičiai anglies atomo molekulėje, bet taip pat ir struktūra. Visi parafinai gali būti suskirstyti normaliai (kiekvienas C atomas gali jungtis ne daugiau kaip dviem anglies atomais) ir izotopas (C atomas gali būti prijungtas prie keturių kitų C-atomų, dėl kurių molekulė turi erdvinę struktūrą). Pavyzdžiui, pentanas ir 2,2-dimetilpropanas turi tokią pačią molekulinę masę ir cheminę formulę C5H12, tačiau jų cheminės ir fizinės savybės skirsis: lydymosi temperatūra minus 129,7 ° C ir minus 16,6 ° C, verdanti 36,1 ° C ir 9,5 ° C. Izomerai yra lengviau patekti į chemines reakcijas nei įprastiniai angliavandeniliai, turintys tokį patį skaičių C atomų.
Характерные химические свойства алканов — это pakaitinės reakcijos, įskaitant halogeninimą arba sulfonavimą. Dėl sąveikos su parafino chloru radikaliu mechanizmu, veikiant temperatūrai arba šviesai, susidaro metano chloro dariniai: chlormetanas CH3Cl, dichlormetanas CH2Cl2, trichlormetanas CHCl3 ir anglies tetrachloridas. Kai alkanai yra sulfonuojami UV šviesoje, gaunami sulfonilchloridai: R-H + SO2 + Cl2 → R-SO2-Cl + HCl. Šios medžiagos naudojamos paviršinio aktyvumo medžiagoms gaminti.