Многое в квантовой механике остается за гранью suprasti, daug atrodo fantastinis. Tas pats pasakytina ir apie kvantinius skaičius, kurių pobūdis šiandien yra paslaptingas. Straipsnyje apibūdinama sąvoka, tipai ir bendrieji darbo su jais principai.
Bendrosios charakteristikos

Целые или полуцелые квантовые числа у физических Kiekiai apibūdina visus diskretinių dydžių, apibūdinančių kvantų sistemą (molekulę, atomą, branduolį) ir elementines daleles, rūšis. Jų taikymas yra glaudžiai susijęs su Plancko konstanta egzistavimu. Diskretiškumas, einantis procesų mikrocosmoje, atspindi kvantinius skaičius ir jų fizinę reikšmę. Jie pirmą kartą buvo pristatyti, norint apibūdinti atomo spektrų įstatymus. Bet atskirų kiekių fizinė prasmė ir diskrecija buvo atskleista tik kvantinėje mechanikoje.
Набор, который определяет исчерпывающе состояние ši sistema vadinama užbaigta. Visos valstybės, atsakingos už galimas tokių rinkinių vertes, sudaro pilną valstybių sistemą. Chemijos kvantiniai skaičiai, turintys elektrono laisvės laipsnį, nustato tris erdvines koordinates ir vidinį laisvės laipsnį - sukimą.
Elektronų konfigūracijos ir atomai
В атоме располагаются ядро и электроны, между kurios veikia elektrostatinio pobūdžio jėgas. Energija didės, kai atstumas tarp branduolio ir elektrono sumažės. Galima energija laikoma nuliu, jei ji yra be galo pašalinta iš šerdies. Ši būsena naudojama kaip nuoroda. Tai lemia santykinę elektrono energiją.
Elektrono apvalkalas yra energijos lygių rinkinys. Priklausymas vienam iš jų išreiškiamas pagrindiniu kvantiniu skaičiumi n.

Pagrindinis numeris
Tai reiškia konkretų energijos lygį suorbitalių, turinčių panašias reikšmes, rinkinys, susidedantis iš natūralių skaičių: n = 1, 2, 3, 4, 5 ... Kai elektronas pereina iš vieno lygio į kitą, pagrindinis kvantinis skaičius pasikeičia. Reikėtų nepamiršti, kad ne visi lygiai yra užpildyti elektronais. Užpildant atomo apvalkalą, įgyvendinamas mažiausios energijos principas. Šiuo atveju jo būsena vadinama nesužadinta ar pagrindine.
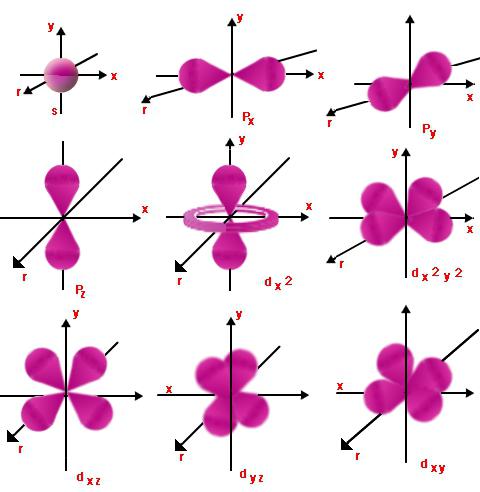
Orbita skaičiai
Kiekviename lygyje yra orbitos.Tie, kurių energija yra panaši, sudaro pakopą. Toks priskyrimas atliekamas naudojant orbitinį (arba, kaip dar kitaip vadinama, šoną) kvantinį skaičių l, kuris ima sveikųjų skaičių reikšmes nuo nulio iki n - 1. Taigi elektronas, kurio pagrindinis ir orbitinis kvantinis skaičius n ir l gali būti lygus, pradedant l = 0 ir baigiant l = n - 1.
Tai rodo atitinkamo judėjimo pobūdįsublygis ir energijos lygis. Jei l = 0 ir bet kokia n reikšmė, elektronų debesis bus rutulio formos. Jo spindulys bus tiesiogiai proporcingas n. Kai l = 1, elektronų debesis įgaus begalybės arba aštuonios figūros formą. Kuo didesnė l reikšmė, tuo forma taps sudėtingesnė, o elektrono energija padidės.
Magnetiniai skaičiai
Ml yra orbitos (šono) projekcijakampinis impulsas vienai ar kitai magnetinio lauko krypčiai. Tai rodo tų orbitalių, kurių skaičius l yra tas pats, orientaciją erdvėje. Ml gali turėti skirtingas reikšmes 2l + 1, nuo -l iki + l.
Vadinamas dar vienas magnetinis kvantinis skaičiusspin - ms, kuris yra tinkamas judesio skaičiaus momentas. Norėdami tai suprasti, galima įsivaizduoti elektrono sukimąsi tarsi apie savo ašį. Ms gali būti -1/2, +1/2, 1.
Apskritai bet kurio elektrono absoliuti sukinio vertė yra s = 1/2, o ms reiškia jo projekciją į ašį.
Pauli principas: atome negali būti dviejų elektronų su 4 panašiais kvantiniais skaičiais. Bent vienas iš jų turėtų būti puikus.
Atomų formulių sudarymo taisyklė.
- Minimalios energijos principas. Palei jį, pagal Klechkovsky taisykles, pirmiausia užpildomi lygiai ir pakopos, esančios arčiau šerdies.
- Elemento padėtis rodo, kaip elektronai pasiskirsto energijos lygiuose ir pakopose:
- skaičius sutampa su atomo krūviu ir jo elektronų skaičiumi;
- periodinis skaičius atitinka energijos lygių skaičių;
- grupės numeris sutampa su valentinių elektronų skaičiumi atome;
- pogrupis rodo jų pasiskirstymą.

Elementariosios dalelės ir branduoliai
Kvantiniai skaičiai dalelių fizikojeyra jų vidinės savybės, lemiančios sąveiką ir virsmo dėsnius. Be sukinio s, tai yra elektrinis krūvis Q, kuris visoms pradinėms dalelėms yra lygus nuliui arba sveikas skaičius, neigiamas arba teigiamas; bariono krūvis B (dalelėje - nulis arba vienas, antidalelėje - nulis arba minusas vienas); leptono krūviai, kur Le ir Lm yra lygūs nuliui, vienas, o antidalelėje - nulis ir minusas vienas; izotopinis sukimasis su sveikuoju arba puse sveikojo skaičiaus; keistumas S ir kiti. Visi šie kvantiniai skaičiai taikomi tiek elementarioms dalelėms, tiek atominiams branduoliams.
Plačiąja šio žodžio prasme jie vadinami fiziniaiskiekiai, lemiantys dalelės ar sistemos judėjimą ir kurie yra išsaugoti. Tačiau visai nebūtina, kad jie priklausytų diskrečiam visų galimų verčių spektrui.









