Il livello di conoscenza della struttura di atomi e molecole nel XIXsecolo non ha permesso di spiegare il motivo per cui gli atomi formano un certo numero di legami con altre particelle. Ma le idee degli scienziati erano in anticipo sui tempi e la valenza è ancora oggetto di studio come uno dei principi di base della chimica.
Dalla storia dell'origine del concetto di "valenza degli elementi chimici"
Prominente chimico inglese del XIX secolo EdwardFrankland ha introdotto il termine "legame" nell'uso scientifico per descrivere il processo di interazione degli atomi tra loro. Lo scienziato ha notato che alcuni elementi chimici formano composti con lo stesso numero di altri atomi. Ad esempio, l'azoto lega tre atomi di idrogeno a una molecola di ammoniaca.

Nel maggio 1852, Frankland avanzò l'ipotesi in meritoche esiste un numero specifico di legami chimici che un atomo può formare con altre minuscole particelle di materia. Frankland ha usato la frase "forza di connessione" per descrivere quella che in seguito sarebbe stata chiamata valenza. Il chimico britannico stabilì quanti legami chimici formano gli atomi dei singoli elementi, noti a metà del XIX secolo. Il lavoro di Frankland è diventato un importante contributo alla chimica strutturale moderna.

Sviluppo delle opinioni
Il chimico tedesco F.A.Kekulé ha dimostrato nel 1857 che il carbonio è tetrabasico. Nel suo composto più semplice, il metano, nascono legami con 4 atomi di idrogeno. Lo scienziato ha usato il termine "basicità" per denotare le proprietà degli elementi per attaccare una quantità strettamente definita di altre particelle. In Russia, i dati sulla struttura della materia furono sistematizzati da A.M. Butlerov (1861). La teoria del legame chimico è stata ulteriormente sviluppata grazie alla dottrina dei cambiamenti periodici nelle proprietà degli elementi. Il suo autore è un altro eccezionale chimico russo, DI Mendeleev. Ha dimostrato che la valenza degli elementi chimici nei composti e altre proprietà sono dovute alla posizione che occupano nella tavola periodica.


La capacità di visualizzare le molecole è una cosadegli indubbi meriti della teoria della valenza. I primi modelli apparvero nel 1860 e dal 1864 sono state utilizzate formule strutturali, che sono cerchi con un segno chimico all'interno. Un trattino tra i simboli degli atomi indica un legame chimico e il numero di queste linee è uguale al valore di valenza. Negli stessi anni vengono prodotti i primi modelli ball-and-stick (vedi foto a sinistra). Nel 1866, Kekulé propose un disegno stereochimico di un atomo di carbonio sotto forma di un tetraedro, che incluse nel suo libro di testo "Chimica organica".
Valenza degli elementi chimici e occorrenzale connessioni furono studiate da G. Lewis, che pubblicò i suoi lavori nel 1923 dopo la scoperta dell'elettrone. Questo è il nome delle più piccole particelle caricate negativamente che fanno parte dei gusci degli atomi. Nel suo libro, Lewis ha usato punti attorno ai quattro lati di un simbolo chimico per rappresentare gli elettroni di valenza.
Valenza di idrogeno e ossigeno
Prima della creazione del sistema periodico, la valenzaEra consuetudine confrontare gli elementi chimici nei composti con quegli atomi per i quali è noto. Idrogeno e ossigeno sono stati scelti come standard. Un altro elemento chimico ha attratto o sostituito un certo numero di atomi di H e O.

In questo modo sono state determinate le proprietà nei composti con idrogeno monovalente (la valenza del secondo elemento è indicata da un numero romano):
- HCl - cloro (I):
- X2O è ossigeno (II);
- HH3 - azoto (III);
- B4 - carbonio (IV).
Negli ossidi K2O, CO, N2oh3, SiO2, COSÌ3 la valenza dell'ossigeno di metalli e non metalli è stata determinata raddoppiando il numero di atomi aggiunti di O. Sono stati ottenuti i seguenti valori: K (I), C (II), N (III), Si (IV), S ( VI).
Come determinare la valenza degli elementi chimici
Ci sono regolarità nella formazione di un legame chimico con la partecipazione di coppie di elettroni comuni:
- La valenza tipica dell'idrogeno è I.
- La solita valenza dell'ossigeno è II.
- Per gli elementi non metallici, la valenza più bassa può essere determinata dalla formula 8 - il numero del gruppo in cui si trovano nel sistema periodico. Il più alto, se possibile, è determinato dal numero del gruppo.
- Per gli elementi dei sottogruppi secondari, la massima valenza possibile è uguale al numero del loro gruppo nella tavola periodica.
La determinazione della valenza degli elementi chimici dalla formula del composto viene eseguita utilizzando il seguente algoritmo:
- Scrivi il valore noto per uno degli elementi sopra il segno chimico. Ad esempio, in Mn2oh7 la valenza dell'ossigeno è II.
- Calcola il valore totale, per il quale è necessario moltiplicare la valenza per il numero di atomi dello stesso elemento chimico nella molecola: 2 * 7 = 14.
- Determina la valenza del secondo elemento per il quale è sconosciuto. Dividi il valore ottenuto nel passaggio 2 per il numero di atomi di Mn nella molecola.
- 14: 2 = 7. La valenza del manganese nel suo ossido superiore è VII.
Valenza costante e variabile
I valori di valenza per l'idrogeno e l'ossigeno sono diversi. Ad esempio, lo zolfo nel composto H2S è bivalente e nella formula SO3 - esavalente. Il carbonio si forma con ossigeno, monossido di CO e anidride carbonica2... Nel primo composto, la valenza di C è II e nel secondo IV. Lo stesso valore in metano CH4.

La maggior parte degli elementi non sono costanti, mavalenza variabile, ad esempio fosforo, azoto, zolfo. La ricerca delle ragioni principali di questo fenomeno ha portato all'emergere di teorie sui legami chimici, concetti del guscio di valenza degli elettroni, orbitali molecolari. L'esistenza di valori diversi della stessa proprietà è stata spiegata dal punto di vista della struttura degli atomi e delle molecole.
Concetti moderni di valenza
Tutti gli atomi sono costituiti da un nucleo positivo,circondato da elettroni caricati negativamente. Il guscio esterno, che formano, non è finito. La struttura completata è la più stabile, contiene 8 elettroni (ottetto). L'emergere di un legame chimico dovuto alle coppie di elettroni condivise porta a uno stato degli atomi energeticamente favorevole.
La regola per formare connessioni ècompletamento del guscio accettando elettroni o rinunciando a elettroni spaiati, a seconda di quale processo è più facile. Se un atomo fornisce particelle negative che non hanno una coppia per la formazione di un legame chimico, allora forma tanti legami quanti sono gli elettroni spaiati. Secondo i concetti moderni, la valenza degli atomi degli elementi chimici è la capacità di formare un certo numero di legami covalenti. Ad esempio, nella molecola di idrogeno solforato H2S zolfo acquisisce valenza II (-), da alloraogni atomo partecipa alla formazione di due coppie di elettroni. Il segno "-" indica l'attrazione di una coppia di elettroni verso un elemento più elettronegativo. Per un valore di valenza meno elettronegativo, aggiungi "+".
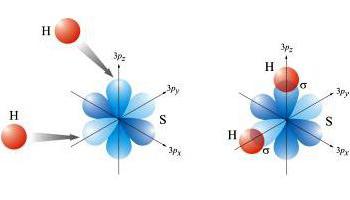
Con il meccanismo donatore-accettore, le coppie di elettroni di un elemento e gli orbitali di valenza liberi di un altro sono coinvolti nel processo.
Dipendenza della valenza dalla struttura dell'atomo
Consideriamo, usando l'esempio del carbonio e dell'ossigeno, come la valenza degli elementi chimici dipende dalla struttura di una sostanza. La tavola periodica dà un'idea delle principali caratteristiche dell'atomo di carbonio:
- segno chimico - C;
- numero articolo - 6;
- carica principale - +6;
- protoni nel nucleo - 6;
- elettroni - 6, di cui 4 esterni, di cui 2 formano una coppia, 2 - spaiati.
Se un atomo di carbonio in CO monoossido forma dueconnessione, quindi solo 6 particelle negative entrano nel suo utilizzo. Per acquisire un ottetto, le coppie devono formare 4 particelle negative esterne. Il carbonio ha valenze IV (+) nel biossido e IV (-) nel metano.
Numero ordinale di ossigeno - 8, valenzail guscio è costituito da sei elettroni, 2 dei quali non formano coppie e prendono parte al legame chimico e all'interazione con altri atomi. La valenza tipica dell'ossigeno è II (-).

Valenza e stato di ossidazione
In molti casi è più comodo da usareil concetto di "stato di ossidazione". Questo è il nome della carica di un atomo, che acquisirebbe se tutti gli elettroni di legame venissero trasferiti a un elemento che ha un valore di elettronegatività (EO) più elevato. Il numero ossidante in una sostanza semplice è zero. Il segno "-" viene aggiunto allo stato di ossidazione dell'elemento più EO, e il segno "+" viene aggiunto allo stato meno elettronegativo. Ad esempio, per i metalli dei sottogruppi principali, sono tipici stati di ossidazione e cariche ioniche pari al numero di gruppo con il segno "+". Nella maggior parte dei casi, la valenza e lo stato di ossidazione degli atomi nello stesso composto sono numericamente uguali. Solo quando si interagisce con più atomi elettronegativi lo stato di ossidazione è positivo, con elementi con EO inferiore - negativo. Il concetto di "valenza" è spesso applicato solo a sostanze di struttura molecolare.







