क्वांटम यांत्रिकी में बहुत सीमा के बाहर रहता हैसमझ, बहुत शानदार लगता है। यही बात क्वांटम संख्याओं पर भी लागू होती है, जिसका स्वरूप आज भी रहस्यमय है। लेख में उनके साथ काम करने की अवधारणा, प्रकार और सामान्य सिद्धांतों का वर्णन किया गया है।
सामान्य विशेषताएं

भौतिक के लिए पूर्णांक या आधा पूर्णांक संख्याएँमात्राएं सभी प्रकार के असतत मूल्यों को निर्धारित करती हैं जो क्वांटा (अणु, परमाणु, नाभिक) और प्राथमिक कणों की प्रणालियों को चिह्नित करती हैं। उनका उपयोग प्लैंक स्थिरांक के अस्तित्व से निकटता से संबंधित है। सूक्ष्म जगत में होने वाली प्रक्रियाओं की असंगतता क्वांटम संख्या और उनके भौतिक अर्थ को दर्शाती है। उन्हें पहली बार एक परमाणु के स्पेक्ट्रा को नियंत्रित करने वाले कानूनों का वर्णन करने के लिए पेश किया गया था। लेकिन अलग-अलग मात्राओं के भौतिक अर्थ और विसंगति का खुलासा केवल क्वांटम यांत्रिकी में ही हुआ।
एक सेट जो एक संपूर्ण स्थिति को परिभाषित करता हैइस प्रणाली को पूर्ण कहा जाता है। ऐसे सेट से संभावित मूल्यों के लिए जिम्मेदार सभी राज्य एक पूर्ण राज्य प्रणाली बनाते हैं। इलेक्ट्रॉन की स्वतंत्रता की डिग्री के साथ रसायन विज्ञान में क्वांटम संख्या तीन स्थानिक निर्देशांक और स्वतंत्रता की आंतरिक डिग्री में निर्धारित करती है - स्पिन।
परमाणुओं में इलेक्ट्रॉनों का विन्यास
एक परमाणु में एक नाभिक और इलेक्ट्रॉनों के बीच होता हैजिसके द्वारा इलेक्ट्रोस्टैटिक प्रकृति के बल कार्य करते हैं। नाभिक और इलेक्ट्रॉन के बीच की दूरी कम होते ही ऊर्जा बढ़ जाएगी। यह माना जाता है कि यदि नाभिक से असीम रूप से हटा दिया जाता है तो संभावित ऊर्जा शून्य होगी। इस राज्य का उपयोग संदर्भ बिंदु के रूप में किया जाता है। इस प्रकार, इलेक्ट्रॉन की सापेक्ष ऊर्जा निर्धारित की जाती है।
इलेक्ट्रॉन खोल ऊर्जा स्तरों का एक समूह है। उनमें से एक के संबंध में प्रिंसिपल क्वांटम नंबर एन द्वारा व्यक्त किया गया है।

मुख्य संख्या
यह एक विशिष्ट ऊर्जा स्तर को संदर्भित करता हैऑर्बिटल्स का एक सेट, जिसमें समान मूल्य होते हैं, जिसमें प्राकृतिक संख्याएं होती हैं: n = 1, 2, 3, 4, 5 ... जब एक इलेक्ट्रॉन एक स्तर से दूसरे स्तर पर जाता है, तो प्रमुख क्वांटम संख्या बदल जाती है। यह ध्यान में रखा जाना चाहिए कि सभी स्तर इलेक्ट्रॉनों से भरे नहीं हैं। एक परमाणु के खोल को भरते समय, कम से कम ऊर्जा का सिद्धांत लागू किया जाता है। इस मामले में, उनके राज्य को अस्पष्टीकृत या बुनियादी कहा जाता है।
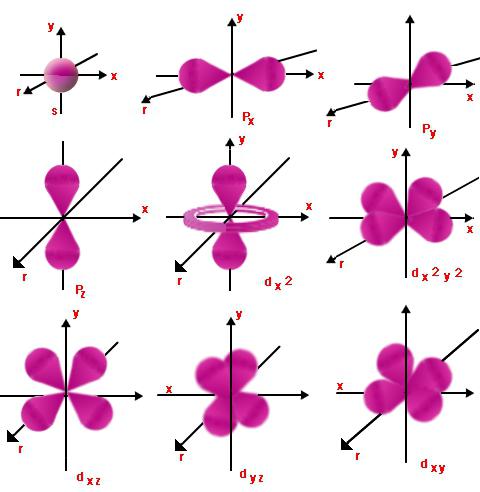
कक्षीय संख्या
प्रत्येक स्तर की कक्षाएँ हैं।उनमें से जो समान ऊर्जा वाले होते हैं वे एक उपशीर्षक बनाते हैं। ऐसा असाइनमेंट ऑर्बिटल (या, जैसा कि इसे भी कहा जाता है, पक्ष) क्वांटम संख्या l का उपयोग करके किया जाता है, जो पूर्णांक के मान को शून्य से n तक ले जाता है - 1. तो एक इलेक्ट्रॉन में मुख्य और कक्षीय क्वांटम संख्या होती है n और l बराबर हो सकते हैं, l = 0 से शुरू होकर l = n - 1 से समाप्त होते हैं।
इससे संबंधित के आंदोलन की प्रकृति का पता चलता हैsublevel और ऊर्जा स्तर। एल = 0 और एन के किसी भी मूल्य के लिए, इलेक्ट्रॉन बादल में एक गोले का आकार होगा। इसका दायरा n के सीधे आनुपातिक होगा। एल = 1 पर, इलेक्ट्रॉन बादल अनंत या आठ का रूप लेगा। एल का मूल्य जितना बड़ा होगा, आकार उतना ही जटिल होगा और इलेक्ट्रॉन ऊर्जा में वृद्धि होगी।
चुंबकीय संख्या
Ml कक्षीय (पक्ष) का प्रक्षेपण हैचुंबकीय क्षेत्र की एक या दूसरी दिशा को कोणीय गति। यह उन ऑर्बिटल्स के स्थानिक अभिविन्यास को दर्शाता है जिनके लिए संख्या एल समान है। Ml के भिन्न मान 2l + 1 हो सकते हैं, -l से + l तक।
एक और चुंबकीय क्वांटम संख्या कहा जाता हैस्पिन - एमएस, जो गति की संख्या का उचित क्षण है। इसे समझने के लिए, कोई इलेक्ट्रॉन के रोटेशन की कल्पना कर सकता है, जैसे कि वह अपनी धुरी के आसपास था। Ms -1 / 2, +1/2, 1 हो सकता है।
सामान्य तौर पर, किसी भी इलेक्ट्रॉन के लिए, स्पिन का निरपेक्ष मान = 1/2 होता है, और एमएस का अर्थ है अक्ष पर इसका प्रक्षेपण।
पाउली का सिद्धांत: एक परमाणु में 4 समान क्वांटम संख्या वाले दो इलेक्ट्रॉन नहीं हो सकते। कम से कम उनमें से एक महान होना चाहिए।
परमाणुओं के सूत्रों को खींचने का नियम।
- न्यूनतम ऊर्जा का सिद्धांत। इस पर, क्लोचकोवस्की के नियमों के अनुसार, स्तर और उपजीवन, जो कोर के करीब स्थित हैं, पहले भरे हुए हैं।
- तत्व की स्थिति इंगित करती है कि इलेक्ट्रॉनों को ऊर्जा के स्तर और उपशीर्षों में कैसे वितरित किया जाता है:
- संख्या परमाणु के आवेश और उसके इलेक्ट्रॉनों की संख्या के साथ मेल खाती है;
- आवधिक संख्या ऊर्जा स्तरों की संख्या से मेल खाती है;
- समूह संख्या परमाणु में वैलेंस इलेक्ट्रॉनों की संख्या के साथ मेल खाती है;
- उपसमूह उनके वितरण को दर्शाता है।

प्राथमिक कण और नाभिक
कण भौतिकी में क्वांटम संख्याउनकी आंतरिक विशेषताएं हैं, जो परिवर्तन की बातचीत और कानूनों को निर्धारित करती हैं। स्पिन एस के अलावा, यह विद्युत आवेश Q है, जो सभी प्राथमिक कणों के लिए शून्य या पूर्णांक, ऋणात्मक या धनात्मक है; बैरोनिक चार्ज बी (एक कण में - शून्य या एक, एक एंटीपार्टिकल में - शून्य या एक शून्य); लेप्टान शुल्क, जहां ले और एलएम शून्य के बराबर हैं, एक और एंटीपार्टिकल में - शून्य और एक शून्य; पूर्णांक या आधा पूर्णांक के साथ समस्थानिक स्पिन; अजनबी एस और अन्य। ये सभी क्वांटम संख्या प्राथमिक कणों और परमाणु नाभिक दोनों पर लागू होती हैं।
शब्द के व्यापक अर्थ में, उन्हें भौतिक कहा जाता हैऐसी मात्राएँ जो किसी कण या प्रणाली की गति को निर्धारित करती हैं और जो संरक्षित होती हैं। हालांकि, यह बिल्कुल भी जरूरी नहीं है कि वे सभी संभावित मूल्यों के असतत स्पेक्ट्रम से संबंधित हों।









