Kemiallisen sidoksen käsitteellä on tärkeä merkitysmerkitys kemian tieteen eri aloilla. Tämä johtuu siitä, että sen avulla yksittäiset atomit pystyvät yhdistymään molekyyleiksi muodostaen kaikenlaisia aineita, jotka puolestaan ovat kemiallisen tutkimuksen kohteena.
Atomien ja molekyylien moninaisuus liittyy erilaisten sidosten syntymiseen niiden välillä. Eri molekyyliluokille on ominaista omat elektronien jakautumisen ominaispiirteet ja siten omat sidontatyyppinsä.
Peruskäsitteet
Kemiallinen sidos kutsua vuorovaikutussarjaajohtaa atomien sitoutumiseen muodostumalla stabiileja monimutkaisemman rakenteen hiukkasia (molekyylit, ionit, radikaalit) sekä aggregaatteja (kiteet, lasit jne.). Näiden vuorovaikutusten luonne on luonteeltaan sähköinen, ja ne syntyvät valenssielektronien jakautumisen aikana lähestyvissä atomissa.
Valence hyväksytty nimeä atomin kykymuodostavat tietyn määrän sidoksia muiden atomien kanssa. Ioniyhdisteissä lahjoitettujen tai kiinnittyneiden elektronien lukumäärä otetaan valenssiarvoksi. Kovalenttisissa yhdisteissä se on yhtä suuri kuin yhteisten elektroniparien lukumäärä.
alapuolella hapetustila ymmärretään ehdolliseksi varaus, joka voisi olla atomilla, jos kaikki polaariset kovalenttiset sidokset olisivat ionisia.
Viestinnän moninaisuutta kutsutaan tarkasteltujen atomien välisten jaettujen elektroniparien määrä.
Kemian eri aloilla tarkastellut sidokset voidaan jakaa kahteen tyyppiseen kemialliseen sidokseen: niihin, jotka johtavat uusien aineiden muodostumiseen (molekyylinsisäiset)ja molekyylien väliset (molekyylien väliset).
Viestinnän perusominaisuudet
Viestinnän energialla kutsutaan energiaksi, jota tarvitaan kaikkien molekyylissä olevien sidosten katkaisemiseksi. Se on myös sidoksen muodostumisen aikana vapautuva energia.
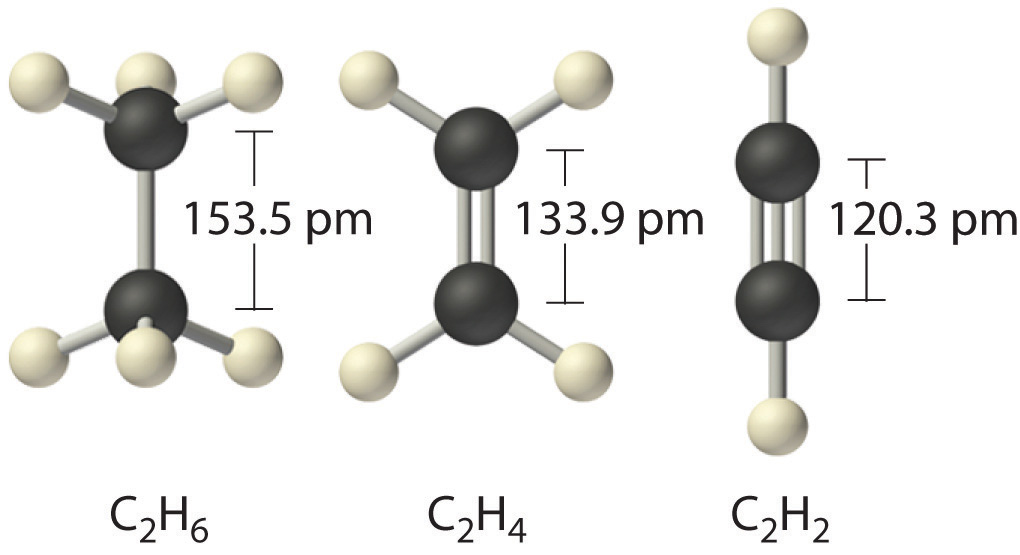
Viestinnän pituus viittaa molekyylin vierekkäisten atomien ytimien väliseen etäisyyteen, jossa vetovoimat ja hylkimisvoimat ovat tasapainossa.
Nämä kaksi atomien kemiallisen sidoksen ominaisuutta mittaavat sen voimakkuutta: mitä lyhyempi pituus ja mitä suurempi energia, sitä vahvempi sidos on.
Valenssikulma on tapana kutsua edustettujen linjojen välistä kulmaa, joka kulkee sidoksen suunnassa atomien ytimien läpi.
Suhteen kuvaustavat
Yleisimmät ovat kaksi lähestymistapaa kvanttimekaniikasta lainatun kemiallisen sidoksen selittämiseen:
Molekyylinen kiertoradamenetelmä. Hän pitää molekyyliä aggregaattinaelektronit ja atomien ytimet, ja kukin erikseen otettu elektroni liikkuu kaikkien muiden elektronien ja ytimien toimintakentällä. Molekyylillä on kiertorakenne, ja kaikki sen elektronit jakautuvat pitkin näitä kiertoratoja. Tätä menetelmää kutsutaan myös MO LCAO: ksi, joka tarkoittaa "molekulaarinen kiertorata - atomien orbitaalien lineaarinen yhdistelmä".
Valenssisidosten menetelmä. Edustaa molekyyliä kahden keskusjärjestelmän järjestelmänämolekyyliset orbitaalit. Lisäksi kukin niistä vastaa yhtä sidosta kahden vierekkäisen atomin välillä molekyylissä. Menetelmä perustuu seuraaviin säännöksiin:
- Kemiallisen sidoksen muodostuminen tapahtuu parillaelektronit, joilla on vastakkaiset pyörivät, jotka sijaitsevat kahden tarkastellun atomin välissä. Muodostunut elektronipari kuuluu kahteen atomiin yhtä lailla.
- Yhden tai toisen atomin muodostamien sidosten lukumäärä on yhtä suuri kuin parittomien elektronien lukumäärä maassa ja viritetyissä tiloissa.
- Jos elektroniset parit eivät osallistu sidoksen muodostumiseen, niitä kutsutaan yksinäisiksi pareiksi.
Elektronegatiivisuus
Aineiden kemiallisen sidoksen tyyppi on mahdollista määrittää sen sisältävien atomien elektronegatiivisuuksien arvojen eron perusteella. Alla elektronegatiivisuus ymmärtää atomien kykyä vetää pois yhteiset elektroniparit (elektronipilvi), mikä johtaa sidoksen polarisaatioon.
On olemassa useita tapoja määritellä arvojakemiallisten alkuaineiden elektronegatiivisuudet. Eniten käytetty on kuitenkin termodynaamiseen dataan perustuva asteikko, jonka L. Pauling ehdotti jo vuonna 1932.

Mitä suurempi ero onatomien elektronegatiivisuus, sitä enemmän sen ionisuus ilmenee. Päinvastoin, yhtäläiset tai läheiset elektronegatiivisuuden arvot osoittavat sidoksen kovalenttisen luonteen. Toisin sanoen on matemaattisesti mahdollista määrittää, millainen kemiallinen sidos havaitaan tietyssä molekyylissä. Tätä varten sinun on laskettava ΔХ - atomien elektronegatiivisuuksien välinen ero kaavalla: ΔX = | X1-X2|.
- Jos ΔX> 1,7, sitten sidos on ioninen.
- Jos 0,5≤ΔX≤1,7, silloin kovalenttinen sidos on polaarinen.
- Jos ΔX = 0 tai lähellä sitä, sidos viittaa kovalenttiseen ei-polaariseen.
Ionisidos
Ionic on yhteys, joka ilmestyyionien välillä tai johtuen yhteisen elektroniparin täydellisestä vetämisestä yhdestä atomista. Aineissa tämän tyyppinen kemiallinen sidos tapahtuu sähköstaattisen vetovoiman avulla.
Ionit ovat varautuneita hiukkasia, jotka ovat muodostuneetelektronien kiinnittymisen tai vapautumisen seurauksena. Jos atomi hyväksyy elektroneja, se saa negatiivisen varauksen ja siitä tulee anioni. Jos atomi luovuttaa valenssielektroneja, siitä tulee positiivisesti varautunut hiukkanen, jota kutsutaan kationiksi.
Se on ominaista yhdisteille, jotka muodostuvattyypillisten metallien atomien vuorovaikutus tyypillisten ei-metallien atomien kanssa. Suurin osa prosessista on atomien halu hankkia vakaat elektroniset kokoonpanot. Tyypillisten metallien ja ei-metallien on annettava tai vastaanotettava vain 1-2 elektronia, minkä ne helposti tekevät.

Ionisen kemiallisen sidoksen muodostumisen mekanismimolekyyliä pidetään perinteisesti natriumin ja kloorin vuorovaikutuksen esimerkissä. Alkalimetalliatomit luovuttavat helposti halogeeniatomin vetämän elektronin. Tämän seurauksena Na-kationi muodostuu+ ja anioni Cl-joita sähköstaattinen vetovoima pitää yhdessä.
Ihanteellista ionisidosta ei ole.Jopa sellaisissa yhdisteissä, joita usein kutsutaan ionisiksi, elektronien lopullista siirtymistä atomista atomiin ei tapahdu. Muodostunut elektronipari on edelleen yleisessä käytössä. Siksi puhutaan kovalenttisen sidoksen ionisuusasteesta.
Ionisidokselle on tunnusomaista kaksi toisiinsa liittyvää pääominaisuutta:
- epäsuora, eli ionin ympärillä oleva sähkökenttä on pallon muotoinen;
- tyydyttymättömyys, toisin sanoen minkä tahansa ionin ympärillä olevien vastakkaisesti varautuneiden ionien määrä määräytyy niiden koon perusteella.
Kovalenttinen kemiallinen sidos
Sidos, joka muodostuu päällekkäisestä elektronisestaei-metallien atomipilviä, toisin sanoen yhteisen elektroniparin suorittamia, kutsutaan kovalenttisiksi sidoksiksi. Jaettujen elektroniparien määrä määrää sidoksen moninaisuuden. Siten vetyatomit on liitetty yhdellä H ··· H-sidoksella, ja happiatomit muodostavat kaksoissidoksen O :: O.
Sen muodostumiseen on kaksi mekanismia:
- Vaihdettavissa - kukin atomi edustaayhden elektronin yhteisen parin muodostuminen: A + B = A: B, kun taas ulkoiset atomiorbitaalit, joihin yksi elektroni sijaitsee, osallistuvat sidoksen toteuttamiseen.
- Luovuttaja-vastaanottaja - sidoksen muodostamiseksi yksi atomeista (luovuttaja) tarjoaa elektroniparin ja toinen (vastaanottaja) tarjoaa vapaan kiertoradan sijoittamiseensa: A +: B = A: B.

Menetelmät elektronipilvien päällekkäisyydestä kovalenttisen kemiallisen sidoksen muodostumisen aikana ovat myös erilaiset.
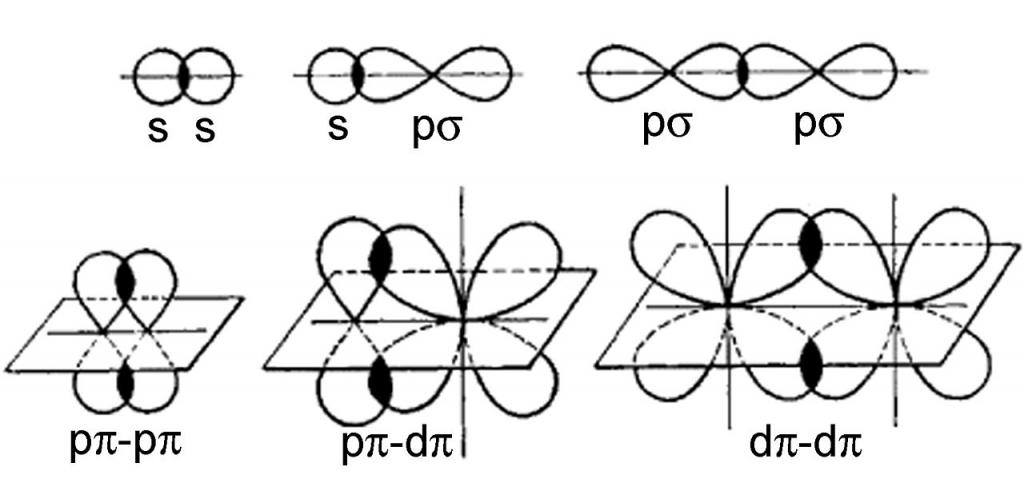
- Suoraan.Pilvien päällekkäisyysalue on suoralla kuvitteellisella viivalla, joka yhdistää tarkasteltavien atomien ytimet. Tässä tapauksessa muodostuu σ-sidoksia. Tässä tapauksessa esiintyvän kemiallisen sidoksen tyyppi riippuu päällekkäisten elektronipilvien tyypistä: s-s, s-p, p-p, s-d tai p-d σ-sidokset. Hiukkasessa (molekyyli tai ioni) vain yksi σ-sidos on mahdollinen kahden vierekkäisen atomin välillä.
- Sivusuunnassa.Se suoritetaan atomituumoja yhdistävän linjan molemmin puolin. Näin muodostuu π-sidos, ja sen lajikkeet ovat myös mahdollisia: p-p, p-d, d-d. Σ-sidoksen lisäksi π-sidosta ei koskaan muodostu; se voi olla molekyyleissä, jotka sisältävät useita (kaksois- ja kolmoissidoksia).
Kovalenttisen sidoksen ominaisuudet
Ne määrittelevät kemiallisen ja fysikaalisenyhteyksien ominaisuudet. Aineiden minkä tahansa kemiallisen sidoksen tärkeimmät ominaisuudet ovat sen suuntaus, napaisuus ja polarisoituvuus sekä kylläisyys.
Suunta yhteys johtuu molekyylin erityispiirteistäaineiden rakenne ja niiden molekyylien geometrinen muoto. Sen ydin on, että elektronipilvien paras päällekkäisyys on mahdollista tietyllä suunnalla avaruudessa. Muunnoksia σ- ja π-sidosten muodostumisesta on jo tarkasteltu edellä.
alapuolella kylläisyys ymmärtää atomien kyvyn muodostaa tietty määrä kemiallisia sidoksia molekyylissä. Kovalenttisten sidosten lukumäärä kutakin atomia varten on rajoitettu ulkoreittien lukumäärällä.
Vastakkaisuus yhteys riippuu arvoeroistaatomien elektronegatiivisuudet. Elektronien jakautumisen tasaisuus atomien ytimien välillä riippuu siitä. Tämän ominaisuuden kovalenttinen sidos voi olla polaarinen tai ei-polaarinen.
- Jos yhteinen elektronipari kuuluu yhtä suuresti kumpaankin atomiin ja se sijaitsee samalla etäisyydellä niiden ytimistä, kovalenttinen sidos on ei-polaarinen.
- Jos yhteinen elektronipari siirtyy yhden atomin ytimeen, muodostuu kovalenttinen polaarinen kemiallinen sidos.
Polarisoitavuus ilmaistaan sidoselektronien siirtymällä allaulkoisen sähkökentän toiminta, joka voi kuulua toiseen hiukkaseen, naapurisidoksiin samassa molekyylissä tai tulla ulkoisista sähkömagneettisten kenttien lähteistä. Joten kovalenttinen sidos heidän vaikutuksensa alla voi muuttaa napaisuuttaan.
Orbitaalien hybridisaatio ymmärretään niiden muodon muutoksena kemiallisen sidoksen toteutumisen aikana. Tämä on tarpeen tehokkaimman päällekkäisyyden saavuttamiseksi. Hybridisaatiotyypit ovat seuraavat:
- sp3... Yksi s ja kolme p-orbitaalia muodostavat neljä saman muotoista "hybridi" -bitaalia. Ulkopuolelta se muistuttaa tetraedonia, jonka akselien välinen kulma on 109 °.
- sp2... Yksi s- ja kaksi p-orbitaalia muodostavat tasaisen kolmion, jonka akselien välinen kulma on 120 °.
- sp. Yksi s ja yksi p kiertorata muodostavat kaksi "hybridi" kiertorataa, joiden akselien välinen kulma on 180 °.
Metallisidos
Piiri metalliatomien rakenteesta onmelko suuri säde ja pienen määrän elektroneja läsnä ulko-orbitaaleissa. Tämän seurauksena tällaisissa kemiallisissa alkuaineissa ytimen ja valenssielektronien välinen sidos on suhteellisen heikko ja helposti hajoava.
Metalli sidosta kutsutaan sellaiseksi vuorovaikutukseksi metallien atomien-ionien välillä, joka toteutetaan käyttämällä delokalisoituja elektroneja.
Metallihiukkasissa valenssielektronit voivaton helppo jättää ulommat kiertoradat samoin kuin käyttää niillä tyhjiä paikkoja. Siten sama hiukkanen voi eri aikoina olla atomi ja ioni. Niistä irrotetut elektronit liikkuvat vapaasti koko kideverkon tilavuudessa ja suorittavat kemiallisen sidoksen.

Tämän tyyppisellä sidoksella on yhtäläisyyksiä ionisten jakovalenttinen. Ionisidoksen osalta tarvitaan ioneja metallisidoksen olemassaoloon. Mutta jos ensimmäisessä tapauksessa sähköstaattisen vuorovaikutuksen toteuttamiseksi tarvitaan kationeja ja anioneja, niin toisessa negatiivisesti varautuneiden hiukkasten rooli on elektronilla. Jos verrataan metallisidosta kovalenttiseen sidokseen, molempien muodostumiseen tarvitaan yhteisiä elektroneja. Toisin kuin polaarinen kemiallinen sidos, ne eivät kuitenkaan paikannu kahden atomin välillä, vaan kuuluvat kaikkiin kristallihilan metallihiukkasiin.
Lähes kaikkien metallien erityisominaisuudet johtuvat metallisidoksesta:
- plastisuus on läsnä johtuen mahdollisuudesta vaihtaa atomikerroksia kideverkossa elektronikaasun pitämänä;
- metallinen kiilto, joka havaitaan johtuen valonsäteiden heijastumisesta elektroneista (jauhemaisessa tilassa ei ole kidesäleikköä ja siksi elektronit liikkuvat sitä pitkin);
- sähkönjohtavuus, jonka suorittaa varautuneiden hiukkasten virtaus, ja tässä tapauksessa pienet elektronit liikkuvat vapaasti suurten metalli-ionien joukossa;
- lämmönjohtavuus, havaittu johtuen elektronien kyvystä siirtää lämpöä.
Vetysidos
Tämän tyyppistä kemiallista sidosta kutsutaan joskuskovalenttisten ja molekyylien välisten vuorovaikutusten välissä. Jos vetyatomilla on sidos johonkin voimakkaasti elektronegatiivisista elementeistä (kuten fosfori, happi, kloori, typpi), se pystyy muodostamaan lisäsidoksen, jota kutsutaan vedyksi.
Se on paljon heikompi kuin kaikki edellä mainitut sidostyypit (energia enintään 40 kJ / mol), mutta sitä ei voida unohtaa. Siksi kaaviossa oleva vetykemiallinen sidos näyttää katkoviivalta.

Vetysidoksen muodostuminen on mahdollistaluovuttajan ja akseptorin sähköstaattinen vuorovaikutus samanaikaisesti. Suuri ero elektronegatiivisuuden arvoissa johtaa ylimääräisen elektronitiheyden ilmaantumiseen atomeissa O, N, F ja muissa, samoin kuin sen puutteeseen vetyatomissa. Siinä tapauksessa, että tällaisten atomien välillä ei ole olemassa kemiallista sidosta, kun ne ovat riittävän lähellä, vetovoimat aktivoituvat. Tässä tapauksessa protoni on elektroniparin vastaanottaja ja toinen atomi on luovuttaja.
Vetysidos voi syntyä sekä vierekkäisten molekyylien, esimerkiksi veden, karboksyylihappojen, alkoholien, ammoniakin, että molekyylin, esimerkiksi salisyylihapon, välillä.
Vetysidoksen läsnäolo vesimolekyylien välillä selittää useita sen ainutlaatuisia fysikaalisia ominaisuuksia:
- Sen lämpökapasiteetin arvot, dielektrinenläpäisevyyden, kiehumis- ja sulamispisteiden tulisi laskelmien mukaan olla merkittävästi alhaisemmat kuin todelliset, mikä selittyy molekyylien liitettävyydellä ja tarpeella kuluttaa energiaa molekyylien välisten vetysidosten rikkomiseen.
- Toisin kuin muut aineet, laskettaessalämpötilassa veden määrä kasvaa. Tämä johtuu siitä, että molekyylit ovat tietyssä asemassa jään kiderakenteessa ja liikkuvat toisistaan vetysidoksen pituudelta.
Tällä yhteydellä on erityinen rooli eläville.organismeja, koska sen läsnäolo proteiinimolekyyleissä määrää niiden erityisen rakenteen ja siten niiden ominaisuudet. Lisäksi nukleiinihapot, jotka muodostavat DNA: n kaksoiskierteen, ovat myös yhteydessä vetysidoksilla.
Kristallisidokset
Suurimmalla osalla kiinteistä aineista onkristallihila - erityinen keskinäinen järjestely niitä muodostavista hiukkasista. Tällöin havaitaan kolmiulotteinen jaksollisuus, ja atomit, molekyylit tai ionit sijaitsevat solmuissa, jotka on yhdistetty kuvitteellisilla viivoilla. Näiden hiukkasten luonteesta ja niiden välisistä sidoksista riippuen kaikki kristallirakenteet on jaettu atomi-, molekyyli-, ioni- ja metallirakenteisiin.
Ionisen kideverkon kohdat ovatkationit ja anionit. Lisäksi kutakin niistä ympäröi tiukasti määritelty määrä ioneja, joilla on vain vastakkaiset varaukset. Tyypillinen esimerkki on natriumkloridi (NaCl). Niillä on taipumus olla korkeita sulamispisteitä ja kovuutta, koska ne vaativat paljon energiaa hajoamiseen.
Molekyylikiteiden kohdalla ovat kovalenttisen sidoksen muodostamat aineiden molekyylit (esimerkiksi I2). Ne on liitetty toisiinsa heikossa van der Waalsin vuorovaikutuksessa, ja siksi tällainen rakenne on helppo tuhota. Tällaisilla yhdisteillä on alhaiset kiehumis- ja sulamispisteet.
Atomikiteen hila muodostuu atomistakemialliset elementit, joilla on korkeat valenssiarvot. Niitä sitoo vahvat kovalenttiset sidokset, mikä tarkoittaa, että aineet erottuvat korkeilla kiehumispisteillä, sulamispisteillä ja suurella kovuudella. Esimerkki on timantti.
Siten kaikentyyppiset linkit ovat käytettävissäkemikaaleilla on omat ominaisuutensa, jotka selittävät molekyylien ja aineiden hiukkasten vuorovaikutuksen hienovaraisuudet. Yhteyksien ominaisuudet riippuvat niistä. Ne määrittävät kaikki ympäristössä esiintyvät prosessit.








