Los compuestos orgánicos más simples son los hidrocarburos saturados e insaturados. Estos incluyen sustancias de la clase de alcanos, alquinos, alquenos.
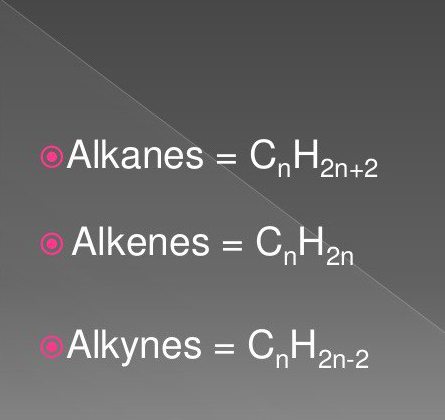
Sus fórmulas incluyen átomos de hidrógeno y carbono en una secuencia y cantidad específicas. Son comunes en la naturaleza.
Determinación de alquenos
Su otro nombre es olefinas o hidrocarburos de etileno. Así es como se llamó a esta clase de compuestos en el siglo XVIII cuando se descubrió el líquido aceitoso, el cloruro de etileno.
Los alquenos incluyen sustancias que consisten enelementos de hidrógeno y carbono. Se clasifican como hidrocarburos acíclicos. Su molécula contiene un enlace doble (insaturado) que conecta dos átomos de carbono entre sí.
Fórmulas de alquenos
Cada clase de compuestos tiene su propia designación química. En ellos, los símbolos de los elementos del sistema periódico indican la composición y estructura del enlace de cada sustancia.

La fórmula general para los alquenos se indica a continuación: CnorteX2n, donde el número n es mayor o igual que 2. Al decodificarlo, se puede ver que por cada átomo de carbono hay dos átomos de hidrógeno.
Las fórmulas moleculares de alquenos homólogos están representadas por las siguientes estructuras: C2X4, C3X6, C4X8, C5X10, C6X12, C7X14, C8X16, C9X18, C10X20... Puede verse que cada hidrocarburo subsiguiente contiene un carbono más y 2 más hidrógeno.
Existe una designación gráfica de la ubicación y el orden de los compuestos químicos entre los átomos de una molécula, que muestra la fórmula estructural de los alquenos. Con la ayuda de rayas de valencia, se indica el enlace de los carbonos con los hidrógenos.
La fórmula estructural de los alquenos se puede representaren forma expandida, cuando se muestran todos los elementos químicos y enlaces. La expresión más concisa de las olefinas no muestra el compuesto de carbono e hidrógeno usando rayas de valencia.
La fórmula esquelética denota la estructura más simple. La línea discontinua representa la base de la molécula, en la que los átomos de carbono están representados por sus extremos superiores y extremos, y los enlaces indican hidrógeno.
Cómo se forman los nombres de olefinas
Basado en la nomenclatura sistemática, la fórmulaLos alquenos y sus nombres están compuestos por la estructura de los alcanos relacionados con los hidrocarburos saturados. Para ello, en nombre de este último, el sufijo -an se sustituye por -ilen o -en. Un ejemplo es la formación de butileno a partir de butano y penteno a partir de pentano.
Para indicar la posición de un doble enlace en relación con los átomos de carbono, indique un número arábigo al final del nombre.
El nombre de los alquenos se basa en la notaciónel hidrocarburo de cadena más larga que contiene un doble enlace. Para el comienzo de la numeración de la cadena, generalmente se elige el final más cercano al compuesto insaturado de átomos de carbono.
Si la fórmula estructural de los alquenos tieneramas, luego indique los nombres de los radicales y su número, y delante de ellos se colocan los números correspondientes al lugar en la cadena de carbono. A esto le sigue el nombre del hidrocarburo en sí. Los números suelen ir seguidos de un guión.
Hay ramas de radicales insaturados. Sus nombres pueden ser triviales o estar formados según las reglas de la nomenclatura sistemática.
Por ejemplo, HNC = CH- se denomina etenilo o vinilo.
Isómeros
Las fórmulas moleculares de los alquenos no pueden indicar isomería. Sin embargo, para esta clase de sustancias, con la excepción de la molécula de etileno, la modificación espacial es inherente.

Los isómeros de los hidrocarburos de etileno pueden ser esqueleto de carbono, posición de enlace insaturado, interclase o espacial.
La fórmula general de los alquenos determina la cantidadátomos de carbono e hidrógeno en la cadena, pero no muestra la presencia y ubicación del doble enlace. Un ejemplo es el ciclopropano como un isómero interclase de C3X6 (propileno). Otros tipos de isomería aparecen en C4X8 o buteno.
Se observa una posición diferente de la conexión insaturada enbuteno-1 o buteno-2, en el primer caso, el compuesto doble se encuentra cerca del primer átomo de carbono, y en el segundo, en el medio de la cadena. La isomería del esqueleto de carbono se puede considerar utilizando metilpropeno (CH3-C (CH3) = CH2) e isobutileno ((CH3) 2C = CH2).
La modificación espacial es inherente al buteno-2 enposición trans y cis. En el primer caso, los radicales laterales se encuentran por encima y por debajo de la cadena de carbono principal con un doble enlace, en el segundo isómero, los sustituyentes están en un lado.
Caracterización de olefinas
La fórmula general de los alquenos determina la condición física de todos los representantes de esta clase. Comenzando con etileno y terminando con butileno (de C2 a C4), las sustancias existen en forma gaseosa. Entonces, el eteno incoloro tiene un olor dulzón, baja solubilidad en agua y su peso molecular es menor que el del aire.
En forma líquida, los hidrocarburos del intervalo homólogo de C5 a C17... A partir del alqueno, que tiene 18 átomos de carbono en la cadena principal, se produce una transición del estado físico a una forma sólida.
Se considera que todas las olefinas tienen poca solubilidad enambiente acuático, pero bueno en disolventes orgánicos, como benceno o gasolina. Su peso molecular es menor que el del agua. Un aumento en la cadena de carbono conduce a un aumento en los indicadores de temperatura durante la fusión y ebullición de estos compuestos.
Propiedades de las olefinas
La fórmula estructural de los alquenos muestra la presencia enel esqueleto de un doble enlace de compuestos π y σ de dos átomos de carbono. Esta estructura de la molécula determina sus propiedades químicas. El enlace π se considera poco fuerte, lo que permite destruirlo con la formación de dos nuevos enlaces σ, que se obtienen como resultado de la unión de un par de átomos. Los hidrocarburos insaturados son donantes electrónicos. Participan en procesos de unión electrofílica.
Una propiedad química importante de todos los alquenos esun proceso de halogenación con liberación de compuestos como sustancias dihalogenadas. Los átomos de halógeno son capaces de formar enlaces dobles con los carbonos. Un ejemplo es la bromación de propileno para formar 1,2-dibromopropano:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Este proceso de neutralización del color en agua de bromo con alquenos se considera una evidencia cualitativa de la presencia de un doble enlace.
Las reacciones importantes incluyen la hidrogenación de olifinas.con la adición de una molécula de hidrógeno bajo la acción de metales catalíticos como platino, paladio o níquel. El resultado son hidrocarburos con un enlace saturado. Las fórmulas para alcanos y alquenos se dan a continuación en la reacción de hidrogenación de buteno:
H3–CH2–CH = CH2 + H2 Ni→ CH3–CH2–CH2–CH3.
El proceso de unir una molécula de haluro de hidrógeno a las olefinas se llama
hidrohalogenación, pasando según la regla,descubierto por Markovnikov. Un ejemplo es la hidrobromación de propileno para formar 2-bromopropano. En él, el hidrógeno se combina con un doble enlace con el carbono, que se considera el más hidrogenado:
H3–CH = CH2 + HBr → CH3–BrCH - CH3.
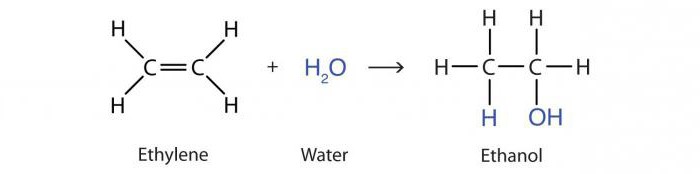
La reacción de adición de agua por alquenos bajo la acción de ácidos se llama hidratación. El resultado es una molécula de alcohol propanol-2:
H3–HC = CH2 + H2O → CH3–OHCH - CH3.
Cuando los alquenos se exponen al ácido sulfúrico, se produce el proceso de sulfonación:
H3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2−OH.
La reacción tiene lugar con la formación de ésteres ácidos, por ejemplo, ácido isopropilsulfúrico.
Los alquenos están sujetos a oxidación durante su combustión bajo la acción del oxígeno con la formación de agua y gas dióxido de carbono:
2 canales3–HC = CH2 + 9O2 → 6CO2 + 6H2O.
La interacción de compuestos olefínicos yel permanganato de potasio diluido en forma de solución conduce a la formación de glicoles o alcoholes diatómicos. Esta reacción también es oxidativa con la formación de etilenglicol y decoloración de la solución:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Las moléculas de alquenos pueden participar en la polimerización con un mecanismo de radicales libres o catiónico-aniónico. En el primer caso, bajo la influencia de peróxidos, se obtiene un polímero del tipo polietileno.
Según el segundo mecanismo, los ácidos actúan como catalizadores catiónicos y las sustancias organometálicas son aniónicas con la liberación de un polímero estereoselectivo.
Que son los alcanos
También se les llama parafinas o limitanteshidrocarburos acíclicos. Tienen una estructura lineal o ramificada, que contiene solo enlaces simples saturados. Todos los representantes de la serie homóloga de esta clase tienen la fórmula general CnorteX2n + 2.
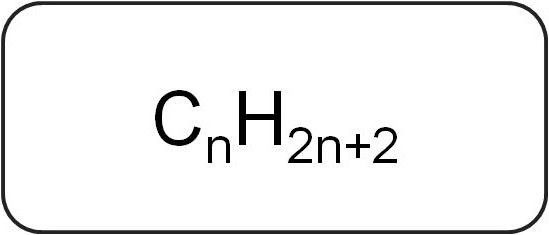
Contienen solo átomos de carbono e hidrógeno. La fórmula general de los alquenos se deriva de la notación de hidrocarburos saturados.
Los nombres de los alcanos y sus características.
El representante más simple de esta clase.es metano. Le siguen sustancias como etano, propano y butano. Su nombre se basa en la raíz de un número en griego, al que se le agrega el sufijo -an. Los nombres de alcanos se enumeran en la nomenclatura de la IUPAC.
La fórmula general para alquenos, alquinos, alcanos incluyesolo dos clases de átomos. Estos incluyen los elementos carbono e hidrógeno. El número de átomos de carbono en las tres clases es el mismo, la diferencia se observa solo en el número de hidrógeno, que puede separarse o unirse. Los compuestos insaturados se obtienen a partir de hidrocarburos saturados. Los representantes de las parafinas en la molécula contienen 2 átomos de hidrógeno más que las olefinas, lo que se confirma con la fórmula general de los alcanos, los alquenos. La estructura de los alquenos se considera insaturada debido a la presencia de un doble enlace.
Si relacionamos el número de átomos de hidrógeno y carbono en los alcanos, entonces el valor será el máximo en comparación con otras clases de hidrocarburos.
Comenzando con metano y terminando con butano (de C1 a C4), las sustancias existen en forma gaseosa.
En forma líquida, los hidrocarburos del intervalo homólogo de C5 a C16... Comenzando con un alcano, que tiene 17 átomos de carbono en la cadena principal, se produce una transición del estado físico a una forma sólida.
Se caracterizan por isomería en el esqueleto carbónico y modificaciones ópticas de la molécula.
En las parafinas, se consideran valencias de carbono.completamente ocupado por carbonos o hidrógenos vecinos para formar un enlace de tipo σ. Desde el punto de vista químico, esto provoca sus propiedades débiles, por lo que los alcanos se denominan hidrocarburos saturados o saturados, desprovistos de afinidad.
Entran en reacciones de sustitución asociadas con halogenación radical, sulfocloración o nitración de la molécula.
Las parafinas sufren oxidación, combustión o descomposición a altas temperaturas. Bajo la acción de los aceleradores de reacción, se eliminan los átomos de hidrógeno o se deshidrogenan los alcanos.
Que son los alquinos
También se denominan hidrocarburos acetilénicos, que tienen un triple enlace en la cadena de carbono. La estructura de los alquinos se describe mediante la fórmula general CnorteX2n - 2... Se puede ver en él que, a diferencia de los alcanos, los hidrocarburos acetilénicos carecen de cuatro átomos de hidrógeno. Son reemplazados por un triple enlace formado por dos compuestos π.
Esta estructura determina las propiedades químicas de esta clase. La fórmula estructural de los alquenos y alquinos muestra claramente la insaturación de sus moléculas, así como la presencia de un doble (H2C꞊CH2) y enlaces triples (HC≡CH).
El nombre de los alquinos y sus características.
El representante más simple es el acetileno.o HC≡CH. También se le llama etina. Proviene del nombre de un hidrocarburo saturado, en el que se elimina el sufijo -an y se agrega -in. En los nombres de alquinos largos, el número indica la ubicación del triple enlace.
Conociendo la estructura de saturados yinsaturado, es posible determinar bajo qué letra se designa la fórmula general de los alquinos: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. La tercera opción es la respuesta correcta.
Comenzando con acetileno y terminando con butano (de C2 a C4), las sustancias son de naturaleza gaseosa.

En forma líquida, hay hidrocarburos del intervalo homólogo de C5 a C17... Comenzando con el alquino, que tiene 18 átomos de carbono en la cadena principal, se produce una transición del estado físico a una forma sólida.
Se caracterizan por isomería en el esqueleto carbónico, en la posición del triple enlace, así como en modificaciones interclase de la molécula.
En términos de características químicas, los hidrocarburos acetilénicos son similares a los alquenos.
Si los alquinos tienen un triple enlace terminal, entoncesactuar como un ácido para formar sales de alquinido, por ejemplo, NaC≡CNa. La presencia de dos enlaces π hace que la molécula de acetledina sódica sea un nucleófilo fuerte que entra en reacciones de sustitución.
El acetileno se somete a cloración en presencia de cloruro de cobre para obtener dicloroacetileno, condensación bajo la acción de haloalquinos con liberación de moléculas de diacetileno.
Las alcalinas están involucradas en reacciones de adición.electrofílico, cuyo principio es la base de la halogenación, hidrohalogenación, hidratación y carbonilación. Sin embargo, estos procesos son más débiles que los de los alquenos con doble enlace.
Para los hidrocarburos acetilénicos, son posibles reacciones de adición nucleofílica de moléculas de alcohol, amina primaria o sulfuro de hidrógeno.








