I det periodiske bord er et sådant kemisk elementsom arsen, indtager en position på metal-ikke-metal grænsen. I sin aktivitet ligger den mellem hydrogen og kobber. Ikke-metallisk natur manifesteres i det faktum, at han er i stand til at udvise oxidationstilstanden på -3 (AsH3 - Arsine). Forbindelser med en positiv oxidationstilstand +3 har amfotere egenskaber, og med en grad på +5 manifesteres de sure egenskaber. Hvad er arsenoxid?

Oxider og hydroxider
Følgende arsenoxider findes: As2Oh3 og as2Oh5. Der er også tilsvarende hydroxider:
- Metharinsyre HAsO2.
- Orthomycerinsyre H3ASO3.
- Metharinsyre HAsO3.
- Orthomycerinsyre H3ASO4.
- Pyrominsyre H4es2Oh7.

Hvad er arsentrioxid?
Arsen danner to oxider, heraf As2Oh3 har navnet trioxid.Det er et stof, der ofte bruges til at behandle, men det er ikke et helt ufarligt kemikalie. Dette er en uorganisk forbindelse, som er den vigtigste kilde til organoarseniske forbindelser (forbindelser indeholdende en kemisk binding med carbon) og mange andre. Mange applikationer af As2Oh3 er kontroversielle på grund af elementets giftige karakter. Handelsnavnet på denne forbindelse er Trisenox.
Trioxid Oversigt
Den kemiske formel af arsenitrioxid er As2Oh3. Molekylvægten af denne forbindelse er197.841 g / mol. Der er mange måder at lave dette oxid på. En af dem er ristning af sulfidmalm. Den kemiske reaktion er som følger:
2AS2Oh3 + 9O2 → 2As2Oh3 + 6SO2
Большинство оксидов может быть получено в som et biprodukt for behandling af andre malmer. Arsenopyrit er en almindelig urenhed i guld og kobber, og det frigiver arsenitrioxid ved opvarmning i luften. Dette kan føre til alvorlig forgiftning.

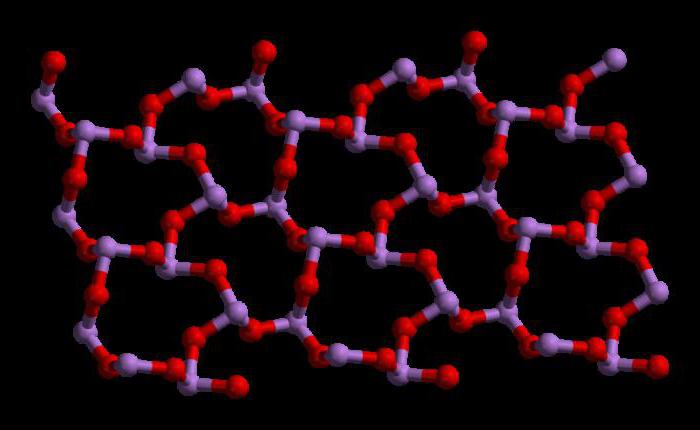
Arsenisk Trioxid Struktur
Arsentrioxid har formlen As4Oh6 i væske- og gasfaserne (under 800 ° C). I disse faser er det isostrukturelt med fosfortrioxid (P4Oh6). Men ved temperaturer over 800 ° C Som4Oh6 bryder ned til molekylær As2Oh3. I denne fase er det isostrukturelt med diisotrontrioxid (N2Oh3). I sin faste tilstand viser denne forbindelse polymorf kapacitet (evnen til at eksistere i to eller flere former for en krystallinsk struktur).
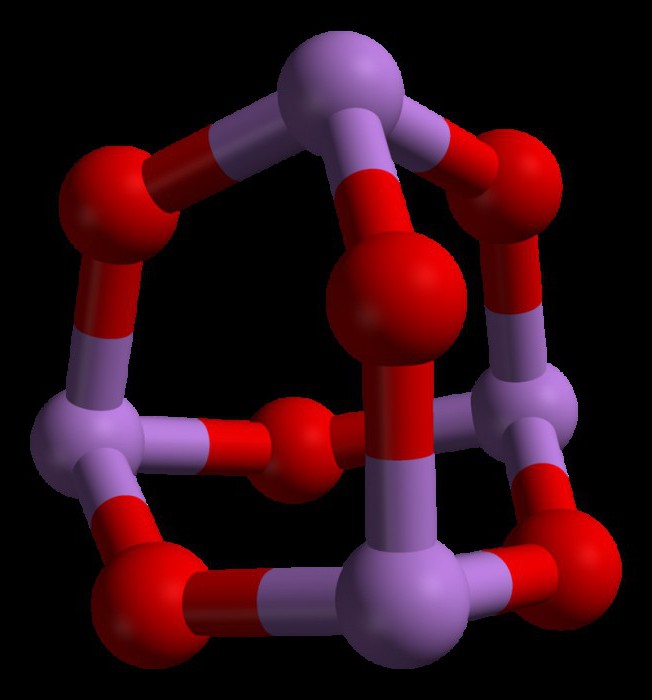
Egenskaber af arsenitrioxid
Nogle af de vigtigste egenskaber af arsenitrioxid er som følger:
- Trioxidopløsninger danner svage syrer med vand. Dette skyldes det faktum, at forbindelsen er et amfotert arsenoxid.
- Det er opløseligt i alkaliske opløsninger og giver arsenater.
- Arsentrioxid har en høj opløselighed i saltsyre (HCI) og giver endelig arsen-triklorid og koncentreret syre.
- Han giver pentoxid (As2Oh5) i nærvær af stærke oxidationsmidler, såsom hydrogenperoxid, ozon og salpetersyre.
- Det er næsten uopløseligt i organiske opløsningsmidler.
- Det ligner et hvidt faststof i normal fysisk tilstand.
- Den har et smeltepunkt på 312,2 ° C og et kogepunkt på 465 ° C.
- Tætheden af dette stof er 4,15 g / cm3.
Anvendelsen af arsentrioxid i medicin
Denne kemikalie tilhører klassenantitumormidler og anvendes til behandling af cancer. Arsenisk toksicitet er velkendt. Men arsenitrioxid er et kemoterapeutisk stof og har været anvendt til behandling af visse former for kræft i mange år. Løsningen anvendt til denne behandling kaldes Fowler-opløsning. I 1878 rapporterede Boston City Hospital, at denne løsning kan være effektiv til at reducere antallet af hvide blodlegemer hos mennesker.
Som et resultat, As2Oh3 blev hovedsagelig brugt til at behandleleukæmi, indtil den blev erstattet af strålebehandling. Men efter 1930'erne genvandt han sin popularitet i behandlingen af leukæmi, indtil moderne kemoterapi optrådte. Dette arsenoxid blev betragtet som den bedste behandling for kronisk myelogen leukæmi. Selv i dag er dette stof brugt til at behandle en bestemt type akut promyelocytisk leukæmi med mislykket retinoid eller anthracyclin kemoterapi. Det bruges også til behandling af kronisk myeloid leukæmi, multiple myelom, akut myeloid leukæmi, lymfom, lymfekræft.

Trioxid brug
Arsentrioxid anvendes meget iproduktion af farveløst glas. Denne forbindelse er også nyttig i elektronik til at skabe halvledere og nogle legeringer. Den bruges i maling. Arsenitrioxid kan være en effektiv behandling for en hjernetumor.
Tidligere blev dette stof anvendt i tandlægevidenskab, men da det er en meget giftig forbindelse, blev dets anvendelse af moderne tandlæger afbrudt. Arsenoxid (formel As2Oh3) bruges også som træbeskyttelsesmiddel, men sådanne materialer er forbudt i mange dele af verden. I kombination med kobberacetat producerer arsentrioxid et lyst grønt pigment.
Meget giftigt stof
Trioxidet selv er højt.toksicitet. Derfor er det altid nødvendigt at tage de nødvendige forholdsregler inden brug. Det kan være meget farligt i følgende tilfælde:
- Måltid. Hvis As2Oh3 ved et uheld kommer ind i fordøjelseskanalen, du har brug forkontakt straks lægen. Det anbefales ikke at forsøge at fremkalde brekninger, før du søger lægehjælp. Det er nødvendigt at fjerne tykke tøj, fjerne slipset, fjern knæet, bæltet osv.
- Hudkontakt.I tilfælde af kontakt med nogen overflade af kroppen, skyll straks det berørte område med rigeligt vand. Forurenet tøj og sko bør fjernes straks og vaskes før genbrug. Ved alvorlig hudkontakt skal du straks søge lægehjælp. Kan det være nyttigt til desinfektion vask af det inficerede område med sæbe og antibakterielle creme ansøgning.
- Øjenkontakt. Hvis As2Oh3 kommer i kontakt med øjnene, den første ting du har brug forgør, fjern eventuelle kontaktlinser og skyl øjnene med rigeligt vand i 15 minutter. Det anbefales at bruge koldt vand. Parallelt med dette skal man ringe til en ambulance.
- Indånding.Personer, der indåndede denne gas, skal placeres andre steder med frisk luft. Og også du skal straks søge lægehjælp. Hvis vejrtrækning er vanskelig, skal ilt injiceres straks. Hvis offeret ikke kan trække vejret på egen hånd, skal kunstig åndedræt udføres.
- Это соединение может оказывать ядовитое menneskelig eksponering. Hvis en overdreven mængde af den indtages, kan arsenitrioxid endda føre til døden. Sikkerhedsbriller og handsker bør altid bruges under arbejdet med As2Oh3. Arbejde skal altid udføres i et godt ventileret område.

Bivirkninger
Almindelige bivirkninger af dette stof omfatter symptomer som:
- dårlig appetit
- opkastning;
- kvalme;
- mavesmerter
- forstoppelse;
- hovedpine;
- træthed;
- svimmelhed;
- feber;
- vejrtrækningsproblemer;
- højt antal hvide blodlegemer
- højt blodsukker
- hududslæt.
Mindre almindelige bivirkninger omfatter:
- tør mund
- forvirret vejrtrækning
- brystsmerter
- lavt antal hvide blodlegemer
- muskel- og knoglesmerter
- hævelse af ansigt og øjne;
- diarré;
- rysten;
- lavt blodsukker
- lavt iltniveau i blodet.
Sjælden som bivirkninger2Oh3:
- uregelmæssigt hjerteslag (det kan endda føre til døden);
- vægtøgning;
- besvimelse;
- distraktion;
- koma;
- hævede mave;
- mørkning af huden.
Livstruende symptomer på eksponering for arsentrioxid er vægtøgning, feber, åndedrætsbesvær, åndenød, brystsmerter, hoste.
Arsentrioxid er meget giftigtet stof, der endda kan føre til død. Det har dog nytten inden for det medicinske område. Tag altid forholdsregler.

Kemiske reaktioner
Arsen trioxid er en amfoterehøjere arsenoxid, og dets vandige opløsninger er svagt sure. Det er således let opløseligt i alkaliske opløsninger til fremstilling af arsenater. Det er mindre opløseligt i syrer med undtagelse af saltsyre.
Kun med stærke oxidationsmidler, såsom ozon, brintperoxid og salpetersyre, dannes arsenisk pentaoxid derfra med en +5 grad af surhed.2Oh5. Hvad angår oxidationsresistens, er arsentrioxid anderledes end fosfortrioxid, der let brænder til fosforpentoxid. Reduktion giver elementær arsen eller arsin (AsH3).

Arsen pentoxid
Den kemiske formel for pentoxid er As2Oh5. Dets molmasse er 229,8402 g / mol. Det er et hvidt hygroskopisk pulver med en densitet på 4,32 g / cm3. Smeltepunkt når 315 ° C, klsom han begynder at nedbryde. Stoffet har god opløselighed i vand og alkohol. Egenskaber ved arsenoxid gør det meget giftigt og miljøfarligt. Denne uorganiske forbindelse, som er mindre almindelig, yderst giftig og derfor kun finder begrænset kommerciel anvendelse, i modsætning til højere arsenoxid (formel As2Oh3).
Arsen er primært kendt som gift ogkræftfremkaldende. Dets trioxid er et vandopløseligt pulver, der producerer en farveløs, smagløs og lugtfri opløsning. Det var en populær måde at dræbe i middelalderen. Dens brug fortsætter i dag, men til fredelige formål og i små mængder.



