Na dlouhou dobu se vědci pokusili přinést singlteorie vysvětlující strukturu molekul popisuje jejich vlastnosti s ohledem na jiné látky. Aby to dokázali, museli popsat povahu a strukturu atomu, představit pojmy „valence“, „elektronová hustota“ a mnoho dalších.
Teorie teorie

Chemická struktura látek byla první, která nás zajímalaItalský Amadeus Avogadro. Začal studovat hmotnost molekul různých plynů a na základě jeho pozorování předložil hypotézu o jejich struktuře. Ale nestal se prvním, kdo o tom podal zprávu, ale čekal, až jeho kolegové dosáhnou podobných výsledků. Poté se metoda získávání molekulové hmotnosti plynů stala známou jako Avogadro zákon.
Nová teorie přiměla další vědce k výzkumu. Mezi nimi byli Lomonosov, Dalton, Lavoisier, Proust, Mendeleev a Butlerov.
Butlerovova teorie

Formulace „teorie chemické struktury“se poprvé objevil ve zprávě o struktuře látek, která v roce 1861 reprezentovala Butlerov v Německu. V následných publikacích se nezměnil a zakořenil v análech dějin vědy. To se stalo předzvěstí několika nových teorií. Ve svém dokumentu uvedl vědec svůj vlastní pohled na chemickou strukturu látek. Zde jsou některé z jeho bodů:
- atomy v molekulách se vzájemně spojují na základě počtu elektronů v jejich vnějších orbitálech;
- změna v pořadí spojování atomů vede ke změně vlastností molekuly a vzhledu nové látky;
- chemické a fyzikální vlastnosti látek závisí nejen na tom, které atomy jsou zahrnuty do jejího složení, ale také na pořadí jejich vzájemných vazeb, jakož i na vzájemném ovlivňování;
- za účelem stanovení molekulárního a atomového složení látky je nezbytné provést řetězec následných transformací.
Geometrická struktura molekul

Chemická struktura atomů a molekul bylao tři roky později sám Butlerov. Představuje fenomén izomerismu do vědy a předpokládá, že i při stejném kvalitativním složení, ale odlišné struktuře, se látky budou od sebe v řadě indikátorů lišit.
O deset let později se objeví doktrína trojrozměrnéhomolekulární struktura. Všechno to začíná publikací Van't Hoffové o jeho teorii kvartérního systému valencí v atomu uhlíku. Moderní vědci rozlišují dvě oblasti stereochemie: strukturální a prostorové.
Strukturální část je dále rozdělena naskeletální izomerismus a pozice. To je důležité vzít v úvahu při studiu organických látek, když je jejich kvalitativní složení statické a dynamika podléhá pouze počtu atomů vodíku a uhlíku a pořadí jejich sloučenin v molekule.
V nich je nezbytný prostorový izomerismuspřípady, kdy existují sloučeniny, jejichž atomy jsou umístěny ve stejném pořadí, ale v prostoru je molekula umístěna odlišně. Optický izomerismus (když se stereoizomery vzájemně zrcadlí), diastereomerismus, geometrický izomerismus a další se rozlišují.
Atomy v molekulách

Klasická chemická struktura molekulyznamená přítomnost atomu v něm. Je hypoteticky jasné, že atom samotný v molekule se může změnit a také se mohou změnit jeho vlastnosti. Závisí to na tom, co jej obklopují další atomy, vzdálenost mezi nimi a vazby, které poskytují sílu molekuly.
Moderní učenci, kteří chtějí sladit obecnou teoriiteorie relativity a kvantové teorie, vezměte jako výchozí polohu skutečnost, že když se vytvoří molekula, atom ji opustí pouze jádro a elektrony a sám přestane existovat. Samozřejmě, že k takové formulaci hned nedorazili. Bylo provedeno několik pokusů zachovat atom jako jednotku molekuly, ale všechny nedokázaly uspokojit náročnou mysl.
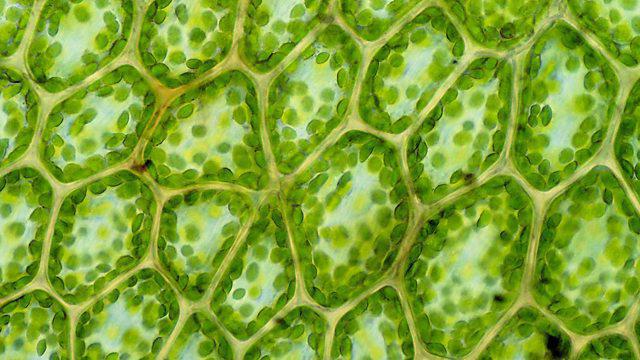
Struktura, chemické složení buňky
Pojem „složení“ znamená spojení všech látek, které se podílejí na tvorbě a životě buňky. Tento seznam obsahuje téměř celou tabulku periodických prvků:
- je neustále přítomno osmdesát šest prvků;
- dvacet pět z nich je určujících pro normální život;
- asi dvacet dalších je naprosto nezbytné.
Pět nejlepších výherců je otevřeno kyslíkem, obsahemkterý v buňce dosahuje sedmdesát pět procent v každé buňce. Vzniká při rozkladu vody, je nezbytná pro reakce buněčného dýchání a dodává energii pro další chemické interakce. Dalším důležitým je uhlík. Je základem všech organických látek a je také substrátem pro fotosyntézu. Bronz získává vodík - nejhojnější prvek ve vesmíru. To je také nalezené v organických sloučeninách na stejné úrovni jako uhlík. Je to důležitá složka vody. Čestné čtvrté místo zaujímá dusík, který je nezbytný pro tvorbu aminokyselin a v důsledku toho proteiny, enzymy a dokonce i vitamíny.
Chemická struktura buňky zahrnuje méněpopulární prvky jako vápník, fosfor, draslík, síra, chlor, sodík a hořčík. Společně zabírají asi jedno procento z celkového množství látky v buňce. Rozlišují se také mikroelementy a ultramikroelementy, které se nacházejí v živých organismech ve stopových množstvích.