โซเดียมเป็นโลหะอัลคาไลชนิดหนึ่ง ตารางองค์ประกอบทางเคมีแสดงให้เห็นว่าเป็นอะตอมของช่วงที่สามและกลุ่มแรก
คุณสมบัติทางกายภาพ
ในส่วนนี้จะพิจารณาถึงลักษณะโซเดียมในมุมมองของฟิสิกส์ ในการเริ่มต้น ในรูปแบบที่บริสุทธิ์ มันคือของแข็งสีเงินที่มีความมันวาวของโลหะและมีความแข็งต่ำ โซเดียมอ่อนมากจนใช้มีดกรีดได้ง่าย จุดหลอมเหลวของสารนี้ค่อนข้างต่ำและอยู่ที่ 79 องศาเซลเซียส มวลอะตอมของโซเดียมก็เล็กเช่นกันเราจะพูดถึงมันในภายหลัง ความหนาแน่นของโลหะนี้คือ 0.97 g / cm3.

ลักษณะทางเคมีของโซเดียม
องค์ประกอบนี้มีกิจกรรมที่สูงมาก -สามารถทำปฏิกิริยากับสารอื่น ๆ ได้อย่างรวดเร็วและรุนแรง นอกจากนี้ตารางองค์ประกอบทางเคมียังช่วยให้คุณสามารถกำหนดค่าเช่นมวลโมลาร์ - สำหรับโซเดียมคือยี่สิบสาม หนึ่งโมลคือปริมาณของสารที่มี 6.02 x 10 ยกกำลัง 23 ของอะตอม (โมเลกุล ถ้าสารนั้นซับซ้อน) เมื่อทราบมวลโมลาร์ของธาตุแล้ว คุณจะสามารถกำหนดได้ว่าปริมาณโมลของสารหนึ่งๆ จะมีน้ำหนักเท่าใด ตัวอย่างเช่น โซเดียม 2 โมลมีน้ำหนัก 46 กรัม ดังที่ได้กล่าวไว้ข้างต้น โลหะชนิดนี้มีปฏิกิริยาทางเคมีมากที่สุดชนิดหนึ่ง โดยเป็นด่าง ตามลำดับ ออกไซด์ของโลหะนี้สามารถสร้างเป็นด่าง (ด่างแก่)
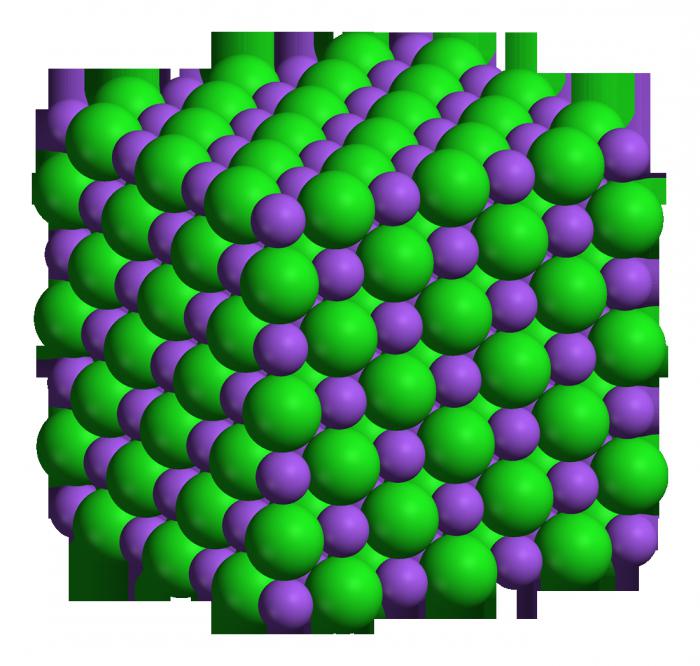
ออกไซด์เกิดขึ้นได้อย่างไร
สารทั้งหมดในกลุ่มนี้ รวมทั้งสารที่อยู่ในกรณีที่มีโซเดียมสามารถทำได้โดยการเผาต้นฉบับ ดังนั้นโลหะจะทำปฏิกิริยากับออกซิเจนซึ่งนำไปสู่การก่อตัวของออกไซด์ ตัวอย่างเช่น หากคุณเผาโซเดียม 4 โมล เราใช้ออกซิเจน 1 โมล และรับเมทัลออกไซด์ 2 โมล สูตรโซเดียมออกไซด์ - Na2O. สมการปฏิกิริยามีลักษณะดังนี้: 4Na + O2 = 2Na2O. หากคุณเติมน้ำให้กับสารที่เกิดขึ้นจะเกิดด่างขึ้น - NaOH
เอาออกไซด์กับน้ำหนึ่งโมล เราจะได้ฐานสองโมล นี่คือสมการของปฏิกิริยานี้: Na2โอ + โฮ2O = 2NaOHสารที่ได้จะเรียกว่าโซเดียมไฮดรอกไซด์ เนื่องจากมีคุณสมบัติเป็นด่างเด่นชัดและมีปฏิกิริยาทางเคมีสูง เช่นเดียวกับกรดแก่โซเดียมโซดาไฟทำปฏิกิริยาอย่างแข็งขันกับเกลือของโลหะที่ไม่ใช้งานสารประกอบอินทรีย์ ฯลฯ ในระหว่างการทำปฏิกิริยากับเกลือจะเกิดปฏิกิริยาการแลกเปลี่ยน - เกลือใหม่และเบสใหม่จะเกิดขึ้น สารละลายโซเดียมที่กัดกร่อนสามารถทำลายผ้า กระดาษ ผิวหนัง เล็บ ดังนั้นจึงต้องปฏิบัติตามกฎความปลอดภัยขณะใช้งาน โซเดียมไฮดรอกไซด์ใช้ในอุตสาหกรรมเคมีเป็นตัวเร่งปฏิกิริยาเช่นเดียวกับในชีวิตประจำวันเพื่อขจัดปัญหาท่ออุดตัน
ปฏิกิริยากับฮาโลเจน

เหล่านี้เป็นสารธรรมดาประกอบด้วยสารเคมีองค์ประกอบที่อยู่ในกลุ่มที่เจ็ดของระบบธาตุ รายการประกอบด้วยฟลูออรีน ไอโอดีน คลอรีน โบรมีน โซเดียมสามารถทำปฏิกิริยากับพวกมันทั้งหมด ทำให้เกิดสารประกอบ เช่น โซเดียมคลอไรด์ / โบรไมด์ / ไอโอไดด์ / ฟลูออไรด์ ในการทำปฏิกิริยา คุณต้องใช้โลหะที่เป็นปัญหาสองโมล เติมฟลูออรีนหนึ่งโมลลงไป เป็นผลให้เราได้รับโซเดียมฟลูออไรด์ในปริมาณสองโมล กระบวนการนี้สามารถเขียนเป็นสมการได้: Na + F2 = 2NaFโซเดียมฟลูออไรด์ที่เราได้รับนั้นใช้ในการผลิตยาสีฟันป้องกันฟันผุ เช่นเดียวกับผงซักฟอกสำหรับพื้นผิวต่างๆ ในทำนองเดียวกันเมื่อเติมคลอรีนโซเดียมคลอไรด์ (เกลือในครัว) โซเดียมไอโอไดด์ซึ่งใช้ในการผลิตหลอดเมทัลฮาไลด์และโซเดียมโบรไมด์ใช้เป็นยาสำหรับโรคประสาท นอนไม่หลับ ฮิสทีเรียและความผิดปกติอื่น ๆ ของระบบประสาท สามารถรับได้.
ด้วยสารธรรมดาอื่นๆ
ปฏิกิริยาของโซเดียมกับฟอสฟอรัสก็เป็นไปได้เช่นกันกำมะถัน (กำมะถัน), คาร์บอน (คาร์บอน) ปฏิกิริยาทางเคมีดังกล่าวสามารถทำได้เฉพาะเมื่อมีการสร้างสภาวะพิเศษในรูปของอุณหภูมิสูง ดังนั้นปฏิกิริยาการเติมจึงเกิดขึ้น สามารถใช้เพื่อให้ได้สารเช่นโซเดียมฟอสไฟด์ โซเดียมซัลไฟด์ โซเดียมคาร์ไบด์
ตัวอย่างคือการเข้าร่วมอะตอมของโลหะที่กำหนดให้เป็นอะตอมของฟอสฟอรัส หากเราเอาโลหะที่เป็นปัญหาสามโมลและส่วนประกอบที่สองหนึ่งโมล จากนั้นให้ความร้อน เราก็จะได้โซเดียมฟอสไฟด์หนึ่งโมล ปฏิกิริยานี้สามารถเขียนได้เป็นสมการต่อไปนี้: 3Na + P = Na3NS.นอกจากนี้ โซเดียมยังสามารถทำปฏิกิริยากับไนโตรเจนและไฮโดรเจนได้อีกด้วย ในกรณีแรกไนไตรด์ของโลหะนี้จะก่อตัวเป็นไฮไดรด์ สมการปฏิกิริยาเคมีต่อไปนี้สามารถยกมาเป็นตัวอย่างได้: 6Na + N2 = 2Na3NS; 2Na + H2 = 2NaH ในการดำเนินการโต้ตอบครั้งแรกจำเป็นต้องมีการคายประจุไฟฟ้า ประการที่สองคืออุณหภูมิสูง

ปฏิกิริยากับกรด
เกี่ยวกับคุณสมบัติทางเคมีของสารอย่างง่ายโซเดียมไม่ได้จบเพียงแค่นั้น โลหะนี้ยังทำปฏิกิริยากับกรดทั้งหมด อันเป็นผลมาจากปฏิกิริยาเคมีดังกล่าว เกลือโซเดียมและไฮโดรเจนจึงเกิดขึ้น ตัวอย่างเช่น เมื่อโลหะที่เป็นปัญหาทำปฏิกิริยากับกรดไฮโดรคลอริก เกลือในครัวและไฮโดรเจนจะก่อตัวขึ้น ซึ่งจะระเหยไป ปฏิกิริยานี้สามารถแสดงได้โดยใช้สมการปฏิกิริยา: Na + HCl = NaCl + H2... ปฏิกิริยาเคมีประเภทนี้เรียกว่าปฏิกิริยาการแทนที่ คุณยังสามารถใช้เกลือได้ เช่น ฟอสเฟต ไนเตรต ไนไตรต์ ซัลเฟต ซัลไฟต์ โซเดียมคาร์บอเนต
6ปฏิกิริยากับเกลือ
โซเดียมทำปฏิกิริยากับเกลือของโลหะทุกชนิด ยกเว้นโพแทสเซียมและแคลเซียม (มีฤทธิ์ทางเคมีมากกว่าธาตุที่เป็นปัญหา) ในกรณีที่คล้ายกัน ปฏิกิริยาการแทนที่จะเกิดขึ้นเช่นเดียวกับก่อนหน้านี้ อะตอมของโลหะที่อยู่ในการพิจารณาจะแทนที่อะตอมของโลหะที่อ่อนตัวทางเคมี ดังนั้น โดยการผสมโซเดียมสองโมลและแมกนีเซียมไนเตรตหนึ่งโมล เราจะได้โซเดียมไนเตรตในปริมาณสองโมล เช่นเดียวกับแมกนีเซียมบริสุทธิ์ - หนึ่งโมล คุณสามารถเขียนสมการของปฏิกิริยานี้ได้ดังนี้: 2Na + Mg (NO3)2 = 2NaNO3 + มก. เกลือโซเดียมอื่นๆ สามารถเตรียมได้ในลักษณะเดียวกัน นอกจากนี้ วิธีนี้สามารถใช้เพื่อให้ได้โลหะจากเกลือของพวกมัน
จะเกิดอะไรขึ้นถ้าคุณเติมน้ำลงในโซเดียม
นี่อาจเป็นหนึ่งในสิ่งที่พบได้บ่อยที่สุดสารต่างๆ บนโลก และด้วยเหตุนี้ โลหะที่เป็นประเด็นจึงสามารถเข้าสู่ปฏิกิริยาเคมีได้ ในกรณีนี้ โซดาไฟหรือโซเดียมไฮดรอกไซด์ที่กล่าวถึงข้างต้นจะถูกสร้างขึ้น

เพื่อที่จะทำปฏิกิริยาดังกล่าว คุณจะต้องทำโซเดียมสองโมลเติมน้ำลงไปด้วยในปริมาณสองโมลด้วยและด้วยเหตุนี้เราจึงได้รับไฮดรอกไซด์สองโมลและไฮโดรเจนหนึ่งโมลซึ่งจะถูกปล่อยออกมาในรูปของก๊าซที่มีกลิ่นฉุน
โซเดียมและผลกระทบต่อสิ่งมีชีวิต
เมื่อตรวจสอบโลหะนี้จากจุดเคมีแล้วมาดูกันว่าคุณสมบัติทางชีววิทยาของโซเดียมเป็นอย่างไร เป็นหนึ่งในองค์ประกอบการติดตามที่สำคัญ ประการแรก มันเป็นหนึ่งในองค์ประกอบของเซลล์สัตว์ มันทำหน้าที่สำคัญ: ร่วมกับโพแทสเซียม รักษาศักยภาพของเมมเบรน มีส่วนร่วมในการก่อตัวและการแพร่กระจายของแรงกระตุ้นเส้นประสาทระหว่างเซลล์ เป็นองค์ประกอบทางเคมีที่จำเป็นสำหรับกระบวนการออสโมติก (ซึ่งจำเป็น เช่น สำหรับการทำงานของเซลล์ไต ). นอกจากนี้ โซเดียมมีหน้าที่ในความสมดุลของเกลือน้ำของเซลล์ นอกจากนี้ หากไม่มีองค์ประกอบทางเคมีนี้ จะไม่สามารถขนส่งกลูโคสในเลือดได้ ซึ่งจำเป็นต่อการทำงานของสมอง โลหะนี้ยังมีส่วนร่วมในกระบวนการหดตัวของกล้ามเนื้อ

ธาตุนี้จำเป็นไม่เพียง แต่สำหรับสัตว์เท่านั้น -โซเดียมยังทำหน้าที่สำคัญในร่างกายของพืช: มันมีส่วนร่วมในกระบวนการสังเคราะห์แสง ช่วยขนส่งคาร์โบไฮเดรต และยังจำเป็นสำหรับการส่งผ่านสารอินทรีย์และอนินทรีย์ผ่านเยื่อ
ส่วนเกินและการขาดโซเดียม
เพื่อเนื้อหาที่เพิ่มขึ้นของสารเคมีนี้ธาตุในร่างกายอาจทำให้ได้รับเกลือมากเกินไปเป็นเวลานาน อาการของโซเดียมส่วนเกินอาจทำให้อุณหภูมิร่างกายเพิ่มขึ้น บวม ตื่นตัวทางประสาทเพิ่มขึ้น และการทำงานของไตบกพร่อง หากมีอาการดังกล่าว คุณต้องกำจัดเกลือในครัวและอาหารที่มีโลหะนี้จำนวนมากออกจากอาหาร (ตามรายการด้านล่าง) แล้วจึงปรึกษาแพทย์ทันที ระดับโซเดียมต่ำในร่างกายยังนำไปสู่อาการไม่พึงประสงค์และความผิดปกติของอวัยวะ องค์ประกอบทางเคมีนี้สามารถล้างออกได้ด้วยการใช้ยาขับปัสสาวะเป็นเวลานานหรือเมื่อดื่มน้ำบริสุทธิ์ (กลั่น) เท่านั้นโดยมีเหงื่อออกเพิ่มขึ้นและร่างกายขาดน้ำ อาการของการขาดโซเดียม ได้แก่ กระหายน้ำ ผิวหนังแห้งและเยื่อเมือก อาเจียนและคลื่นไส้ เบื่ออาหาร สติสัมปชัญญะและไม่แยแส หัวใจเต้นเร็ว และการหยุดการทำงานของไตเต็มที่
อาหารที่มีโซเดียมสูง
เพื่อหลีกเลี่ยงสูงเกินไปหรือมีองค์ประกอบทางเคมีในร่างกายต่ำเกินไปคุณจำเป็นต้องรู้ว่าอาหารชนิดใดมีส่วนประกอบมากที่สุด ก่อนอื่นนี่คือเกลือในครัวที่กล่าวถึงข้างต้น เป็นโซเดียมสี่สิบเปอร์เซ็นต์ นอกจากนี้ยังสามารถเป็นเกลือทะเล นอกจากนี้ โลหะชนิดนี้ยังพบได้ในซีอิ๊วขาว พบโซเดียมจำนวนมากในอาหารทะเล ได้แก่ สาหร่าย ปลาส่วนใหญ่ กุ้ง ปลาหมึก เนื้อปู คาเวียร์ กั้ง ฯลฯ ปริมาณโซเดียมในพวกมันเกิดจากการที่สิ่งมีชีวิตเหล่านี้อาศัยอยู่ในสภาพแวดล้อมที่มีรสเค็มที่มีความเข้มข้นสูงของเกลือของโลหะต่างๆ ที่สำคัญสำหรับ การทำงานปกติของร่างกาย
การใช้โลหะนี้และสารประกอบบางชนิด
การใช้โซเดียมในอุตสาหกรรมเป็นอย่างมากอเนกประสงค์ ประการแรกสารนี้ใช้ในอุตสาหกรรมเคมี ที่นี่จำเป็นต้องได้รับสาร เช่น ไฮดรอกไซด์ของโลหะที่เป็นปัญหา ฟลูออไรด์ ซัลเฟต และไนเตรต นอกจากนี้ยังใช้เป็นสารรีดิวซ์ที่ทรงพลังเพื่อแยกโลหะบริสุทธิ์ออกจากเกลือ มีโซเดียมทางเทคนิคพิเศษเพื่อการนี้ คุณสมบัติของมันถูกบันทึกใน GOST 3273-75 เนื่องจากคุณสมบัติการรีดิวซ์อย่างแรงที่กล่าวไว้ข้างต้น โซเดียมจึงถูกใช้กันอย่างแพร่หลายในโลหะวิทยา

นอกจากนี้องค์ประกอบทางเคมีนี้พบว่าใช้ในอุตสาหกรรมฟามาเซฟติก ซึ่งจำเป็นต้องได้รับโบรไมด์ ซึ่งเป็นหนึ่งในองค์ประกอบหลักของยากล่อมประสาทและยากล่อมประสาทหลายชนิด นอกจากนี้ โซเดียมสามารถใช้ในการผลิตหลอดปล่อยก๊าซ ซึ่งจะเป็นแหล่งกำเนิดแสงสีเหลืองสดใส สารประกอบทางเคมี เช่น โซเดียมคลอเรต (NaClO3) ทำลายต้นอ่อนจึงใช้เพื่อขจัดสิ่งเหล่านั้นออกจากรางรถไฟเพื่อป้องกันการเติบโตของหลัง โซเดียมไซยาไนด์ใช้กันอย่างแพร่หลายในอุตสาหกรรมเหมืองแร่ทองคำ ด้วยความช่วยเหลือโลหะนี้จึงได้มาจากหิน
วิธีการได้รับโซเดียม
วิธีที่พบบ่อยที่สุดคือการตอบสนองคาร์บอเนตของโลหะที่มีปัญหากับคาร์บอน ในการทำเช่นนี้ จำเป็นต้องให้ความร้อนแก่สารทั้งสองที่ระบุถึงอุณหภูมิประมาณหนึ่งพันองศาเซลเซียส ด้วยเหตุนี้จึงเกิดสารประกอบทางเคมีสองชนิดคือโซเดียมและก๊าซที่มีกลิ่นเหม็น เมื่อโซเดียมคาร์บอเนตหนึ่งโมลทำปฏิกิริยากับคาร์บอนสองโมล จะได้โลหะที่ต้องการสองโมลและคาร์บอนมอนอกไซด์สามโมล สมการของปฏิกิริยารีดิวซ์สามารถเขียนได้ดังนี้: NaCO3 + 2C = 2Na + 3CO ในทำนองเดียวกัน องค์ประกอบทางเคมีนี้สามารถหาได้จากสารประกอบอื่นๆ
ปฏิกิริยาเชิงคุณภาพ
การปรากฏตัวของโซเดียม + เช่นเดียวกับไพเพอร์อื่น ๆ หรือแอนไอออนสามารถกำหนดได้โดยการใช้สารเคมีพิเศษ ปฏิกิริยาเชิงคุณภาพต่อโซเดียมไอออนคือการเผาไหม้ - หากมี เปลวไฟจะเปลี่ยนเป็นสีเหลือง

คุณสามารถหาองค์ประกอบทางเคมีที่เป็นปัญหาในธรรมชาติได้ที่ไหน
อย่างแรกที่กล่าวไปแล้วคือเป็นองค์ประกอบหนึ่งของทั้งเซลล์สัตว์และเซลล์พืช นอกจากนี้ยังพบความเข้มข้นสูงในน้ำทะเล นอกจากนี้โซเดียมยังพบได้ในแร่ธาตุบางชนิด ตัวอย่างเช่น ซิลวิไนต์ สูตรของมันคือ NaCl • KCl เช่นเดียวกับคาร์นัลไลต์ ซึ่งมีสูตรคือ KCl • MgCl2• 6H2โอ.ประการแรกมีโครงสร้างที่แตกต่างกันโดยมีชิ้นส่วนสีสลับกันมีสีส้ม, ชมพู, ฟ้า, แดงอยู่ในสี แร่ธาตุนี้ละลายได้อย่างสมบูรณ์ในน้ำ คาร์นัลไลต์สามารถมีสีต่างกันได้ขึ้นอยู่กับตำแหน่งของการก่อตัวและสิ่งสกปรก อาจเป็นสีแดง สีเหลือง สีขาว สีฟ้าอ่อน และแบบโปร่งใสก็ได้ มันมีแสงสลัวรังสีของแสงหักเหอย่างรุนแรงในนั้น แร่ธาตุทั้งสองนี้ทำหน้าที่เป็นวัตถุดิบในการรับโลหะที่เป็นส่วนหนึ่งขององค์ประกอบ ได้แก่ โซเดียม โพแทสเซียม แมกนีเซียม
นักวิทยาศาสตร์เชื่อว่าโลหะที่เราพิจารณาในบทความนี้เป็นหนึ่งในโลหะที่พบได้บ่อยที่สุด เนื่องจากเศษส่วนของมวลในเปลือกโลกมีค่าเท่ากับสองเปอร์เซ็นต์ครึ่ง





