Арени, којима толуен припада, могу се сматрати дериватима претка и првог члана хомологне серије, бензена. Општа формула једињења која припадају овој класи је Ц.нКс2н - 6... Молекули ароматичних угљоводоника садрже бензенски прстен (циклус, језгро). Формула толуена Ц.7Кс8 одражава припадност супстанце овом великомгрупа органских једињења. Многи људи знају толуен под другим именом - метилбензен. Супстанца се широко користи у индустрији, користи се као органски растварач, средство за уклањање мрља и у друге сврхе.
Шта је толуен?

Хемијска формула толуена - Ц.7Кс8 - могу се писати другачије: Ц.6Кс5–ЦХ3. У овом случају, број атома остаје исти, али постоји приметна разлика од бензена, који је садржан у радикалу - метилу.
Користећи друге принципе номенклатуре, једињење се назива метилбензен и фенилметан. Ово је исти толуен чија је општа формула Ц.7Кс8. Али у првом случају нагласак је на чињеници даједан атом водоника од оних везаних за угљеник у бензенском прстену замењен је метилним радикалом. За друго име је заузет другачији приступ. Верује се да је у метану један водоник замењен фенилним радикалом. Ово је честица у коју се бензен претвара, донирајући атом водоника.
Молекуларна структура

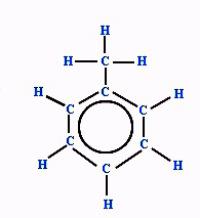
Структурне формуле метилбензена
Електронска густина између атома угљеника,који чине ароматично језгро је равномерно распоређено. Појава се огледа у формули бензена, толуена и других арена са ароматичним знаком (круг у прстену). Такође је забележено присуство метилног радикала на једном од атома угљеника у језгру. Везе између свих честица приказане су цртицама. Структурна формула у овом случају одражава састав и основне структурне карактеристике молекула супстанце.
Поједностављена формула толуена - хексагон сапрстен унутар или цртице који означавају двоструку везу. Метилна група се може налазити на било ком од шест атома језгра, они су међусобно еквивалентни. Недостатак ове методе слике је очигледан. Запис не даје представу о саставу супстанце и еквиваленцији свих веза угљеник-угљеник у прстену.

Производња метилбензена у лабораторији и индустрији
У лабораторији је толуен први пут добијен године1835-1938 П. Пелтиер и А. Девилле. Први научник је дестилирао жвакаћу борову жваку, а други је користио толу балзам екстрахован из јужноамеричког дрвета Толуифера у Колумбији. Тако је настало тривијално име супстанце - толуен. Тренутно се дестилацијом нафте и катрана угља производи накнадна пречишћавања значајна количина метилбензена. У процесу кокса, толуен се издваја из гаса из коксне пећи. У синтези стирена се ослобађа као нуспродукт реакције између бензена и етилена. У лабораторији и индустрији толуен се добија различитим методама.
- Дехидроциклизација ацикличних угљоводоника. Толуен се добија из хептана у присуству катализатора на температури од 300 ° Ц.
- Алкилација бензена, која се назива Фриедел-Црафтсова реакција. Изводи се у присуству катализатора АлЦл3 или других катализатора: Ц.6Х5–Х + ЦХ3Цл = Ц.6Х5–СН3 + ХЦл.
- Интеракција са бромобензеном: Ц.6Х5–Бр + ЦХ3–Бр + 2На = С.6Х5–СН3 + 2НаБр.
- Мешање цинка и крезола: Ц.6Кс4Х3ОХ + Зн = Ц.6Кс5Х3 + ЗнО.
- Прерада толуенсулфонске киселине.
Физичка својства метилбензена

- Бистра, безбојна течност одаје мирис боје.
- Метилбензен се стврдњава на ниским температурама и почиње да се топи на –93 ° Ц.
- Тачка кључања толуена је 110,63 ° Ц. Густина супстанце је 0,8669 г / мл.
- Растворљивост метилбензена у води на температури од 20 ° Ц је 0,47 г / л. Моларна маса супстанце М (Ц.7Кс8) = 92,14 г / мол.
Хемијске особине толуена: оксидација
Карактеристике свих арена одређују се хемијскистабилан циклус од шест атома угљеника. Формула толуена је бензенски прстен, који је формално незасићен, и метилни радикал. Ароматични угљоводоници су по својствима слични алкенима, који се одликују реакцијама адиције. Али атоми водоника у молекулима бензена и његових хомолога могу учествовати у реакцијама супституције, што приближава арене и алкане. Толуен је реактивнији од бензена. Супстанцу карактеришу реакције оксидације.
- Сагоревање праћено ослобађањем угљен-диоксида и стварањем воде: Ц.7Кс8 + 9О2 = 7ЦО2 + 4Х2О.
- Када толуен ступи у интеракцију са калијум перманганатом, метил група у бочном ланцу молекула супстанце се оксидује у карбоксил. Реакцијом се добија бензојева киселина.
Хемијске реакције ароматичног језгра толуена

- Нитровање метилбензена се врши смешомкоји се састоји од концентроване азотне и сумпорне киселине. Нитро група у толуену може да заузима орто и пара положај. Реакција се одвија механизмом електрофилне супституције. На високим температурама настаје експлозивна супстанца тринитротолуен (ТНТ).
- Хидрогенирање водоником преко катализатора доводи до деароматизације и производње метилциклохексана: Ц7Кс8 + 3Х2 = Ц.7Кс14.
- Хлорисање под јаком топлотом или УВ зрачењем резултира стварањем хексахлороциклохексана.
Примене метилбензена
Толуен се широко користи као полазни материјал у органској синтези. Неопходан је материјал у производњи многих супстанци. Примена толуена:
- добијање боја;
- производња средстава за уклањање мрља, детерџената;
- производња експлозивног ТНТ-а;
- употреба лепкова, боја, синтетичких мириса и средстава за чишћење као растварача;
- производња боја за грађевинске радове;
- пуштање производа за нокте;
- производња фармацеутских производа;
- повећање октанског броја горива;
- органска синтеза бензојеве киселине, бензалдехида, бензил хлорида, сахарина, бензил алкохола и других супстанци;
Толуен делује као индустријскирастварач у хемијским чистионицама, користи се у процесу штављења коже. Претеча је већини нафтних деривата, фенола, формалдехида, пестицида и других једињења.

Токсичност толуена
Метилбензен је запаљива супстанца.Смеша пара-ваздух експлодира под одређеним условима. Течни толуен је лако запаљив. Структурна формула даје идеју о саставу и структури, али не садржи информације о утицају супстанце на људско тело. Утврђено је да је толуен токсичан и да има канцерогени ефекат. Паре метилбензена слободно продиру у кожу, респираторне органе, узрокују промене у централном нервном систему, иритацију интегритетних ткива, дерматитис. Када се удису испарења толуена, особа манифестује инхибицију, дрхтање, а активност вестибуларног апарата је поремећена. Потребно је радити са толуеном, бојама, растварачима у гуменим рукавицама, темељно проветрити просторију или користити капуљачу. Метилбензен је слаба опојна супстанца која узрокује злоупотребу толуенских супстанци. Други облици негативних ефеката супстанце:

- иритација очију и оштећење вида у боји;
- продужено излагање може проузроковати губитак слуха;
- висока концентрација у крви узрокује оштећење јетре, некрозу бубрега;
- удисање великих количина испарења доводи до вртоглавице, поспаности, главобоље.
Закључак
Толуен се производи у великим количинама напетрохемијска постројења или добијена као нуспроизвод у погонима кокса. Једињење је драгоцена сировина за органске синтезе великих размера и користи се у фармацеутској индустрији. Метилбензен је укључен у састав многих врста растварача који се користе у раду са бојама и лаковима. Толуен спада у ИИИ класу опасности у класификацији токсичних једињења. Приликом рада са супстанцом, концентрација њених пара у ваздуху не би требало да прелази вредности утврђене санитарним и хигијенским стандардима. При руковању толуеном не сме се дозволити појава отвореног пламена, варница, то може довести до експлозије. Постоје и еколошки проблеми повезани са испуштањем толуена у атмосферу:
- приликом сагоревања уља, различите врсте горива;
- у активним вулканима;
- у шумским пожарима;
- приликом употребе растварача и боја.
Токсична својства толуена, опасност од пожара и експлозије захтевају пажљиво руковање течном материјом и њеним парама.