Много квантне механике остаје изван границаразумевање, много изгледа фантастично. Исто се односи на квантне бројеве чија је природа и данас мистериозна. Чланак описује концепт, врсте и опште принципе рада са њима.
Опште карактеристике

Цели или полуцели квантни бројеви за физичкеКоличине су одређене свим врстама дискретних вредности које карактеришу системе кванта (молекул, атом, језгро) и елементарних честица. Њихова употреба је уско повезана са постојањем Планцкове константе. Дискретност процеса који се јављају у микрокосмосу одражава квантне бројеве и њихово физичко значење. Прво су представљени како би описали законе који управљају спектрима атома. Али физичко значење и дискретност појединачних величина откривени су само у квантној механици.
Скуп који дефинише исцрпно стањеовај систем се назива комплетним. Све државе одговорне за могуће вредности из таквог скупа чине комплетан државни систем. Квантни бројеви у хемији са степенима слободе електрона одређују га у три просторне координате и унутрашњи степен слободе - спин.
Конфигурације електрона у атомима
Атом садржи језгро и електроне, измеђукојим делују силе електростатичке природе. Енергија ће се повећавати како се смањује растојање између језгра и електрона. Верује се да ће потенцијална енергија бити нула ако се бескрајно уклања из језгра. Ово стање се користи као референтна тачка. Тако се одређује релативна енергија електрона.
Електронска љуска је скуп енергетских нивоа. Припадност једном од њих изражава се главним квантним бројем н.

Главни број
Односи се на одређени ниво енергије саскуп орбитала, који имају сличне вредности, који се састоје од природних бројева: н = 1, 2, 3, 4, 5 ... Када се електрон помера са једног нивоа на други, главни квантни број се мења. Треба имати на уму да нису сви нивои испуњени електронима. Приликом пуњења љуске атома примењује се принцип најмање енергије. Његово стање у овом случају назива се неузбуђеним или основним.
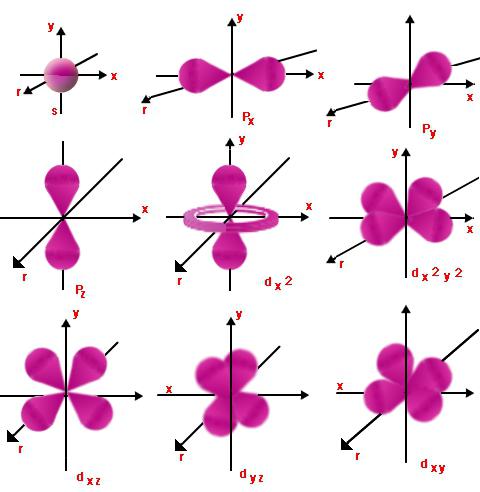
Орбитални бројеви
Сваки ниво има орбитале.Они са сличном енергијом чине подниво. Такав задатак се врши помоћу орбиталног (или, како се још назива и бочног) квантног броја л, који поприма вредности целих бројева од нуле до н - 1. Дакле, електрон који има главни и орбитални квантни број н и л могу бити једнаки, почевши од л = 0 и завршавајући се са л = н - 1.
Ово показује природу кретања дотичногподниво и ниво енергије. За л = 0 и било коју вредност н, облак електрона ће имати облик сфере. Његов радијус ће бити директно пропорционалан н. При л = 1, електронски облак ће добити облик бесконачности или осмице. Што је већа вредност л, облик ће постати сложенији, а енергија електрона ће се повећати.
Магнетни бројеви
Мл је пројекција орбите (бочна)угаони момент на један или други правац магнетног поља. Приказује просторну оријентацију оних орбитала за које је број л исти. Мл може имати различите вредности 2л + 1, од -л до + л.
Позван је још један магнетни квантни бројспин - мс, што је прави тренутак броја кретања. Да би се ово разумело, може се замислити ротација електрона, такорећи око своје осе. Госпођице могу бити -1/2, +1/2, 1.
Генерално, за било који електрон, апсолутна вредност спина је с = 1/2, а мс значи његову пројекцију на осу.
Паулијев принцип: атом не може садржати два електрона са 4 слична квантна броја. Бар један од њих би требао бити сјајан.
Правило састављања формула атома.
- Принцип минималне енергије. На њему се прво попуњавају нивои и поднивои који се налазе ближе језгру, према правилима Клечковског.
- Положај елемента показује како су електрони распоређени по нивоима енергије и поднивоима:
- број се поклапа са наелектрисањем атома и бројем његових електрона;
- периодични број одговара броју нивоа енергије;
- број групе поклапа се са бројем валентних електрона у атому;
- подгрупа приказује њихову дистрибуцију.

Елементарне честице и језгра
Квантни бројеви у физици честицасу њихове унутрашње карактеристике које одређују интеракције и обрасце трансформације. Поред спина с, ово је и електрични набој К, који је за све елементарне честице нула или цео број, негативан или позитиван; барионски набој Б (у честици - нула или један, у античестици - нула или минус један); лептонски набоји, где су Ле и Лм једнаки нули, један, а у античестици - нула и минус један; изотопски спин са целим бројем или полуцелим бројем; необичност С и други. Сви ови квантни бројеви важе и за елементарне честице и за атомска језгра.
У најширем смислу те речи називају се физичкимвеличине које одређују кретање честице или система и које су сачуване. Међутим, уопште није неопходно да припадају дискретном спектру свих могућих вредности.









