Najprostszymi związkami organicznymi są węglowodory nasycone i nienasycone. Należą do nich substancje z klasy alkanów, alkinów, alkenów.
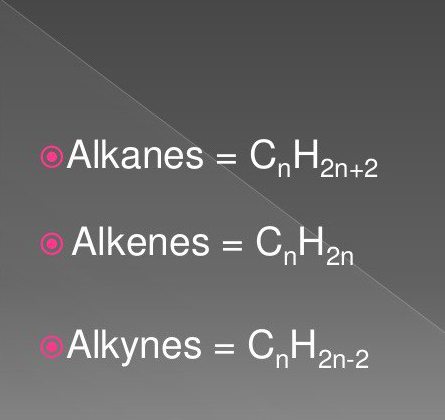
Ich wzory zawierają atomy wodoru i węgla w określonej kolejności i ilości. Mają powszechny charakter.
Oznaczanie alkenów
Ich inna nazwa to olefiny lub węglowodory etylenowe. Tak nazwano tę klasę związków w XVIII wieku, kiedy odkryto oleistą ciecz - chlorek etylenu.
Alkeny obejmują substancje składające się zwodór i pierwiastki węglowe. Zaliczane są do węglowodorów acyklicznych. W ich cząsteczce znajduje się pojedyncze podwójne (nienasycone) wiązanie łączące ze sobą dwa atomy węgla.
Formuły alkenów
Każda klasa związków ma swoje własne oznaczenie chemiczne. W nich symbole elementów układu okresowego wskazują skład i strukturę wiązania każdej substancji.

Ogólny wzór dla alkenów jest następujący: CnX2n, gdzie liczba n jest większa lub równa 2. Podczas dekodowania można zauważyć, że na każdy atom węgla przypadają dwa atomy wodoru.
Wzory cząsteczkowe homologicznych alkenów są reprezentowane przez następujące struktury: C2X4, C3X6, Z4X8, C5X10, C6X12, C7X14, C8X16, C9X18, C10X20... Można zauważyć, że każdy kolejny węglowodór zawiera jeszcze jeden węgiel i 2 więcej wodoru.
Istnieje graficzne oznaczenie położenia i kolejności związków chemicznych między atomami w cząsteczce, które przedstawia wzór strukturalny alkenów. Za pomocą kresek walencyjnych wskazuje się wiązanie między atomami węgla i wodoru.
Można przedstawić wzór strukturalny alkenóww rozszerzonej formie, gdy pokazane są wszystkie pierwiastki chemiczne i wiązania. Bardziej zwięzłe wyrażenie dla olefin nie pokazuje związku węgla i wodoru za pomocą myślników walencyjnych.
Wzór szkieletowy oznacza najprostszą strukturę. Linia przerywana przedstawia podstawę cząsteczki, w której atomy węgla są reprezentowane przez jej wierzchołki i końce, a łącza wskazują wodór.
Jak powstają nazwy olefin
W oparciu o systematyczną nomenklaturę, wzóralkeny i ich nazwy składają się ze struktury alkanów związanej z węglowodorami nasyconymi. Aby to zrobić, w imię tego ostatniego przyrostek -an jest zastępowany przez -ilen lub -en. Przykładem jest tworzenie butylenu z butanu i pentenu z pentanu.
Aby wskazać pozycję wiązania podwójnego w stosunku do atomów węgla, należy podać cyfrę arabską na końcu nazwy.
Nazwa alkenów jest oparta na notacjiwęglowodór o najdłuższym łańcuchu, w którym występuje wiązanie podwójne. Na początek numeracji łańcuchów zwykle wybiera się koniec, który jest najbliższy nienasyconemu związkowi atomów węgla.
Jeśli wzór strukturalny alkenów marozgałęzienia, następnie wskazują nazwy rodników i ich liczbę, a przed nimi umieszczają liczby odpowiadające miejscu w łańcuchu węglowym. Po tym następuje nazwa samego węglowodoru. Liczby są zwykle zakończone łącznikiem.
Istnieją nienasycone radykalne gałęzie. Ich nazwy mogą być trywialne lub tworzone zgodnie z zasadami systematycznej nomenklatury.
Na przykład HNC = CH- jest określane jako etenyl lub winyl.
Izomery
Wzory cząsteczkowe alkenów nie mogą wskazywać na izomię. Jednak w przypadku tej klasy substancji, z wyjątkiem cząsteczki etylenu, nieodłączna jest modyfikacja przestrzenna.

Izomery węglowodorów etylenowych mogą być szkieletem węglowym, wiązaniem nienasyconym, międzyklasowym lub przestrzennym.
Ogólny wzór alkenów określa ilośćatomów węgla i wodoru w łańcuchu, ale nie wykazuje obecności i lokalizacji podwójnego wiązania. Przykładem jest cyklopropan jako izomer międzyklasowy C3X6 (propylen). Inne typy izomerii pojawiają się w C.4X8 lub buten.
Odmienną pozycję połączenia nienasyconego obserwuje się wbuten-1 lub butene-2, w pierwszym przypadku związek podwójny znajduje się w pobliżu pierwszego atomu węgla, aw drugim - w środku łańcucha. Izomeria szkieletu węglowego można rozważać przy użyciu metylopropenu (CH3-C (CH3) = CH2) i izobutylen ((CH3) 2C = CH2)
Przestrzenna modyfikacja jest nieodłącznym elementem butenu-2 calepozycja trans i cis. W pierwszym przypadku rodniki boczne znajdują się powyżej i poniżej głównego łańcucha węglowego z podwójnym wiązaniem, w drugim izomerze podstawniki znajdują się po jednej stronie.
Charakterystyka olefin
Ogólny wzór alkenów określa kondycję fizyczną wszystkich przedstawicieli tej klasy. Począwszy od etylenu, a skończywszy na butylenie (od C.2 do C.4), substancje istnieją w postaci gazowej. Tak więc bezbarwny eten ma słodkawy zapach, niską rozpuszczalność w wodzie, a jego masa cząsteczkowa jest mniejsza niż w powietrzu.
W postaci płynnej węglowodory z przedziału homologicznego od C.5 do C.17... Zaczynając od alkenu, który ma 18 atomów węgla w głównym łańcuchu, następuje przejście ze stanu fizycznego w postać stałą.
Uważa się, że wszystkie olefiny mają słabą rozpuszczalnośćśrodowisko wodne, ale dobre w rozpuszczalnikach organicznych, takich jak benzen lub benzyna. Ich masa cząsteczkowa jest mniejsza niż wody. Wzrost łańcucha węglowego prowadzi do wzrostu wskaźników temperatury podczas topnienia i wrzenia tych związków.
Właściwości olefiny
Wzór strukturalny alkenów wskazuje na obecność wszkielet podwójnego wiązania związków π- i σ- dwóch atomów węgla. Ta struktura cząsteczki determinuje jej właściwości chemiczne. Wiązanie π jest uważane za niezbyt mocne, co umożliwia jego zniszczenie poprzez utworzenie dwóch nowych wiązań σ, które powstają w wyniku przyłączenia pary atomów. Węglowodory nienasycone są donorami elektronicznymi. Biorą udział w procesach przyłączania elektrofilowego.
Ważną właściwością chemiczną wszystkich alkenów jestproces halogenowania z uwolnieniem związków, takich jak substancje dihalogenowane. Atomy halogenu są zdolne do podwójnego wiązania się z atomami węgla. Przykładem jest bromowanie propylenu z wytworzeniem 1,2-dibromopropanu:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Ten proces neutralizacji koloru w wodzie bromowej alkenami jest uważany za jakościowy dowód na obecność podwójnego wiązania.
Do ważnych reakcji należy uwodornianie olifinz dodatkiem cząsteczki wodoru pod działaniem metali katalitycznych, takich jak platyna, pallad czy nikiel. Rezultatem są węglowodory z nasyconym wiązaniem. Wzory alkanów, alkenów podano poniżej w uwodornianiu butenu:
H.3–CH2–CH = CH2 + H2 Żadne→ CH3–CH2–CH2–CH3.
Nazywa się proces przyłączania cząsteczki halogenowodoru do olefin
hydrohalogenacja, zachodząca zgodnie z zasadą,odkryte przez Markownikowa. Przykładem jest bromowodorowanie propylenu do 2-bromopropanu. W nim wodór łączy się z podwójnym wiązaniem z węglem, który jest uważany za najbardziej uwodorniony:
H.3–CH = CH2 + HBr → CH3–BrCH - CH3.
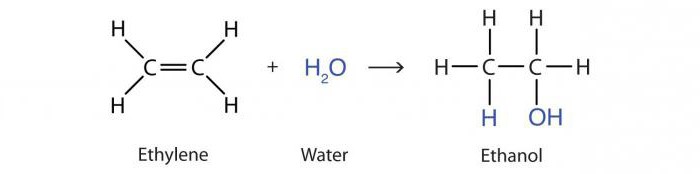
Reakcja dodania wody przez alkeny pod działaniem kwasów nazywa się hydratacją. Rezultatem jest cząsteczka alkoholu propanolu-2:
H.3–HC = CH2 + H2O → CH3–OHCH - CH3.
Gdy alkeny są narażone na działanie kwasu siarkowego, zachodzi proces sulfonowania:
H.3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2−OH.
Reakcja zachodzi z utworzeniem kwaśnych estrów, na przykład kwasu izopropylosiarkowego.
Alkeny podczas spalania ulegają utlenieniu pod działaniem tlenu z wytworzeniem wody i gazowego dwutlenku węgla:
2CH3–HC = CH2 + 9O2 → 6 CO2 + 6H2O.
Interakcja związków olefinowych irozcieńczony nadmanganian potasu w postaci roztworu prowadzi do powstania glikoli lub dwuatomowych alkoholi. Ta reakcja jest również utleniająca z utworzeniem glikolu etylenowego i odbarwieniem roztworu:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Cząsteczki alkenów mogą uczestniczyć w polimeryzacji z mechanizmem wolnorodnikowym lub kationowo-anionowym. W pierwszym przypadku pod wpływem nadtlenków otrzymuje się polimer typu polietylenu.
Zgodnie z drugim mechanizmem kwasy działają jako katalizatory kationowe, a substancje metaloorganiczne są anionowe z uwalnianiem stereoselektywnego polimeru.
Co to są alkany
Nazywa się je również parafinami lub środkami ograniczającymiwęglowodory alifatyczne. Mają strukturę liniową lub rozgałęzioną, która zawiera tylko nasycone wiązania proste. Wszyscy przedstawiciele serii homologicznej tej klasy mają wzór ogólny C.nX2n + 2.
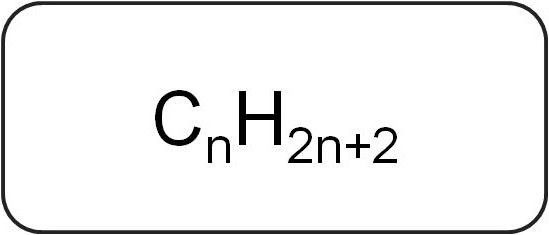
Zawierają tylko atomy węgla i wodoru. Ogólny wzór dla alkenów pochodzi z notacji węglowodorów nasyconych.
Nazwy alkanów i ich charakterystyka
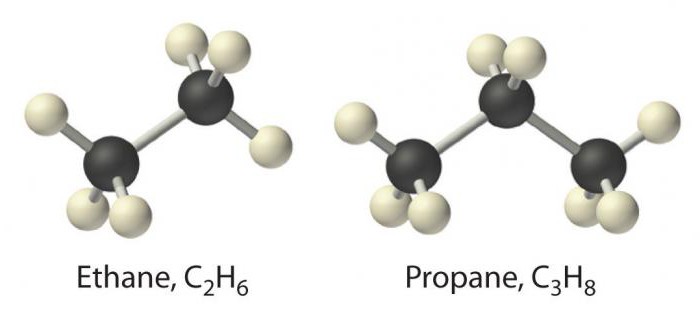
Najprostszy przedstawiciel tej klasyto metan. Za nim znajdują się takie substancje jak etan, propan i butan. Ich nazwa jest oparta na rdzeniu liczby w języku greckim, do którego dodano przyrostek -an. Nazwy alkanów są wymienione w nomenklaturze IUPAC.
Ogólny wzór dla alkenów, alkinów, alkanów obejmujetylko dwa rodzaje atomów. Należą do nich pierwiastki węgla i wodoru. Liczba atomów węgla we wszystkich trzech klasach jest taka sama, różnicę obserwuje się tylko w liczbie wodoru, który można oddzielić lub dołączyć. Związki nienasycone otrzymywane są z węglowodorów nasyconych. Przedstawiciele parafin w cząsteczce zawierają o 2 atomy wodoru więcej niż olefin, co potwierdza ogólny wzór alkanów, alkenów. Struktura alkenów jest uważana za nienasyconą ze względu na obecność podwójnego wiązania.
Jeśli odniesiemy liczbę atomów wodoru i węgla w alkanach, to wartość będzie maksymalna w porównaniu z innymi klasami węglowodorów.
Począwszy od metanu, a skończywszy na butanie (od C.1 do C.4), substancje istnieją w postaci gazowej.
W postaci płynnej węglowodory z przedziału homologicznego od C.5 do C.16... Zaczynając od alkanu, który ma 17 atomów węgla w głównym łańcuchu, następuje przejście ze stanu fizycznego do postaci stałej.
Charakteryzują się izomeria w szkielecie węglowym i optycznymi modyfikacjami cząsteczki.
W parafinach brane są pod uwagę wartościowości węglacałkowicie zajęty przez sąsiednie węgle lub wodory z utworzeniem wiązania typu σ. Z chemicznego punktu widzenia powoduje to ich słabe właściwości, dlatego alkany nazywane są węglowodorami nasyconymi lub nasyconymi, pozbawionymi powinowactwa.
Wchodzą w reakcje podstawienia związane z rodnikowym halogenowaniem, sulfochlorowaniem lub nitrowaniem cząsteczki.
W wysokich temperaturach parafiny ulegają utlenianiu, spalaniu lub rozkładowi. Pod działaniem przyspieszaczy reakcji następuje eliminacja atomów wodoru lub odwodornienie alkanów.
Co to są alkiny
Nazywa się je również węglowodorami acetylenowymi, które mają potrójne wiązanie w łańcuchu węglowym. Strukturę alkinów opisuje ogólny wzór C.nX2n - 2... Można z niego zauważyć, że w przeciwieństwie do alkanów, węglowodory acetylenowe nie mają czterech atomów wodoru. Są one zastąpione potrójnym wiązaniem utworzonym przez dwa związki π.
Taka struktura określa właściwości chemiczne tej klasy. Wzór strukturalny alkenów i alkinów wyraźnie pokazuje nienasycenie ich cząsteczek, a także obecność podwójnego (H2C꞊CH2) i potrójne (HC≡CH).
Nazwa alkinów i ich charakterystyka
Najprostszym przedstawicielem jest acetylenlub HC≡CH. Nazywa się to również etyką. Pochodzi od nazwy węglowodoru nasyconego, w którym usunięto przyrostek -an i dodano -in. W nazwach długich alkinów liczba wskazuje położenie potrójnego wiązania.
Znajomość struktury nasyconych inienasycone, można określić, pod którą literą wskazany jest ogólny wzór alkinów: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Trzecia opcja to poprawna odpowiedź.
Począwszy od acetylenu, a skończywszy na butanie (od C.2 do C.4), substancje mają charakter gazowy.

W postaci płynnej występują węglowodory z przedziału homologicznego od C.5 do C.17... Zaczynając od alkinu, który ma 18 atomów węgla w głównym łańcuchu, następuje przejście ze stanu fizycznego w postać stałą.
Charakteryzują się izomerią w szkielecie węglowym, w pozycji wiązania potrójnego, a także modyfikacjami międzyklasowymi cząsteczki.
Pod względem właściwości chemicznych węglowodory acetylenowe są podobne do alkenów.
Jeśli alkin ma końcowe wiązanie potrójne, to onedziałają jak kwas, tworząc sole alkinidowe, na przykład NaC≡CNa. Obecność dwóch wiązań π sprawia, że cząsteczka acetyledyny sodu jest silnym nukleofilem, który wchodzi w reakcje podstawienia.
Acetylen ulega chlorowaniu w obecności chlorku miedzi z wytworzeniem dichloroacetylenu, kondensacji pod działaniem haloalkinów z uwolnieniem cząsteczek dwuacetylenu.
Alkiny biorą udział w reakcjach addycjielektrofilowy, którego zasada działania jest podstawą halogenowania, hydrohalogenacji, hydratacji i karbonylowania. Jednak takie procesy są słabsze niż w przypadku alkenów z podwójnym wiązaniem.
W przypadku węglowodorów acetylenowych możliwe są nukleofilowe reakcje addycji alkoholu, pierwszorzędowej aminy lub cząsteczek siarkowodoru.








