De eenvoudigste organische verbindingen zijn verzadigde en onverzadigde koolwaterstoffen. Deze omvatten stoffen van de klasse van alkanen, alkynen, alkenen.
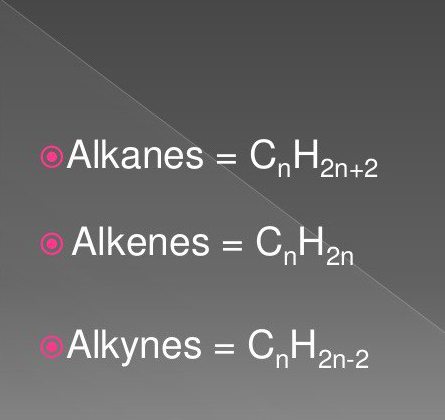
Hun formules bevatten waterstof- en koolstofatomen in een bepaalde volgorde en hoeveelheid. Ze komen veel voor in de natuur.
Bepaling van alkenen
Hun andere naam is olefinen of ethyleenkoolwaterstoffen. Dit is wat deze klasse van verbindingen werd genoemd in de 18e eeuw toen een olieachtige vloeistof - ethyleenchloride - werd ontdekt.
Alkenen omvatten stoffen die bestaan uitwaterstof- en koolstofelementen. Ze zijn geclassificeerd als acyclische koolwaterstoffen. In hun molecuul is er een enkele dubbele (onverzadigde) binding die twee koolstofatomen met elkaar verbindt.
Alkenen-formules
Elke klasse van verbindingen heeft zijn eigen chemische aanduiding. Daarin geven de symbolen van de elementen van het periodiek systeem de samenstelling en structuur van de binding van elke substantie aan.

De algemene formule voor alkenen wordt als volgt aangegeven: CnX2n, waarbij het getal n groter is dan of gelijk is aan 2. Bij het ontcijferen kan worden gezien dat er twee waterstofatomen zijn voor elk koolstofatoom.
Molecuulformules van homologe alkenen worden weergegeven door de volgende structuren: C2X4, C3X6, C4X8, C5X10, C6X12, C7X14, C8X16, C9X18, C10X20... Het is te zien dat elke volgende koolwaterstof nog een koolstof en nog 2 waterstof bevat.
Er is een grafische aanduiding van de locatie en volgorde van chemische verbindingen tussen atomen in een molecuul, die de structuurformule van alkenen laat zien. Met behulp van valentie streepjes wordt de binding tussen koolstofatomen en waterstofatomen aangegeven.
De structuurformule van alkenen kan worden weergegevenin geëxpandeerde vorm, wanneer alle chemische elementen en bindingen worden weergegeven. De beknoptere uitdrukking voor olefinen toont de verbinding van koolstof en waterstof niet met valentie-streepjes.
De skeletformule geeft de eenvoudigste structuur aan. De onderbroken lijn vertegenwoordigt de basis van het molecuul, waarin de koolstofatomen worden voorgesteld door de toppen en uiteinden, en de verbindingen geven waterstof aan.
Hoe olefinennamen worden gevormd
Gebaseerd op de systematische nomenclatuur, de formulealkenen en hun namen zijn samengesteld uit de structuur van alkanen gerelateerd aan verzadigde koolwaterstoffen. Om dit te doen, wordt in naam van de laatste het achtervoegsel -an vervangen door -ilen of -en. Een voorbeeld is de vorming van butyleen uit butaan en penteen uit pentaan.
Om de positie van een dubbele binding ten opzichte van koolstofatomen aan te geven, geeft u een Arabisch cijfer aan het einde van de naam aan.
De naam van alkenen is gebaseerd op de notatiede koolwaterstof met de langste keten die een dubbele binding bevat. Voor het begin van de ketennummering wordt meestal het einde gekozen dat het dichtst bij de onverzadigde verbinding van koolstofatomen ligt.
Als de structuurformule van alkenen heefttakken, geef vervolgens de namen van de radicalen en hun nummer aan, en ervoor staan nummers die overeenkomen met de plaats in de koolstofketen. Dit wordt gevolgd door de naam van de koolwaterstof zelf. De cijfers worden meestal gevolgd door een koppelteken.
Er zijn onverzadigde radicale takken. Hun namen kunnen triviaal zijn of worden gevormd volgens de regels van de systematische nomenclatuur.
HNC = CH- wordt bijvoorbeeld ethenyl of vinyl genoemd.
Isomeren
Moleculaire formules van alkenen kunnen geen isomerie aangeven. Voor deze klasse van stoffen, met uitzondering van het ethyleenmolecuul, is ruimtelijke modificatie echter inherent.

Isomeren van ethyleenkoolwaterstoffen kunnen koolstofskelet, onverzadigde bindingspositie, interklasse of ruimtelijk zijn.
De algemene formule van alkenen bepaalt de hoeveelheidkoolstof- en waterstofatomen in de keten, maar het toont niet de aanwezigheid en locatie van de dubbele binding aan. Een voorbeeld is cyclopropaan als een interklasse-isomeer van C.3X6 (propyleen). Andere soorten isomerie komen voor in C.4X8 of buteen.
Een andere positie van onverzadigde verbinding wordt waargenomen inbuteen-1 of buteen-2, in het eerste geval bevindt de dubbele verbinding zich nabij het eerste koolstofatoom en in het tweede - in het midden van de keten. Isomerie van het koolstofskelet kan worden overwogen met methylpropeen (CH3-C (CH3) = CH2) en isobutyleen ((CH3) 2C = CH2).
Ruimtelijke modificatie is inherent aan buteen-2 intrans en cis positie. In het eerste geval bevinden zijradicalen zich boven en onder de hoofdkoolstofketen met een dubbele binding, in het tweede isomeer bevinden de substituenten zich aan één kant.
Karakterisering van olefinen
De algemene formule van alkenen bepaalt de fysieke conditie van alle vertegenwoordigers van deze klasse. Beginnend met ethyleen en eindigend met butyleen (vanaf C.2 tot C4), stoffen komen in gasvorm voor. Kleurloos etheen heeft dus een zoetige geur, een lage oplosbaarheid in water en het molecuulgewicht is lager dan dat van lucht.
In vloeibare vorm, koolwaterstoffen met het homologe interval van C5 tot C17... Beginnend met alkeen, dat 18 koolstofatomen in de hoofdketen heeft, vindt een overgang van de fysieke toestand naar een vaste vorm plaats.
Alle olefinen worden geacht slecht oplosbaar te zijn inwateromgeving, maar goed in organische oplosmiddelen, zoals benzeen of benzine. Hun molecuulgewicht is lager dan dat van water. Een toename van de koolstofketen leidt tot een toename van temperatuurindicatoren tijdens het smelten en koken van deze verbindingen.
Eigenschappen van olefinen
De structuurformule van alkenen toont de aanwezigheid inhet skelet van een dubbele binding van π- en σ- verbindingen met twee koolstofatomen. Deze structuur van het molecuul bepaalt zijn chemische eigenschappen. De π-binding wordt als niet erg sterk beschouwd, wat het mogelijk maakt deze te vernietigen door de vorming van twee nieuwe σ-bindingen, die worden verkregen als gevolg van de aanhechting van een paar atomen. Onverzadigde koolwaterstoffen zijn elektronische donoren. Ze nemen deel aan elektrofiele hechtingsprocessen.
Een belangrijke chemische eigenschap van alle alkenen ishalogeneringsproces met het vrijkomen van verbindingen zoals dihalogeneerde stoffen. Halogeenatomen kunnen zich dubbel aan koolstofatomen binden. Een voorbeeld is de bromering van propyleen om 1,2-dibroompropaan te vormen:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Dit proces van kleurneutralisatie in broomwater met alkenen wordt beschouwd als kwalitatief bewijs van de aanwezigheid van een dubbele binding.
Belangrijke reacties zijn onder meer de hydrogenering van olifinenmet de toevoeging van een waterstofmolecuul onder invloed van katalytische metalen zoals platina, palladium of nikkel. Het resultaat zijn koolwaterstoffen met een verzadigde binding. Formules van alkanen, alkenen worden hieronder gegeven bij de hydrogenering van buteen:
B3–CH2–CH = CH2 + H2 Ni→ CH3–CH2–CH2–CH3.
Het proces van het verbinden van een waterstofhalogenidemolecuul aan olefinen wordt genoemd
hydrohalogenering, die plaatsvindt volgens de regel,ontdekt door Markovnikov. Een voorbeeld is de hydrobromering van propyleen om 2-broompropaan te vormen. Daarin combineert waterstof met een dubbele binding met koolstof, die als de meest gehydrogeneerde wordt beschouwd:
B3–CH = CH2 + HBr → CH3–BrCH - CH3.
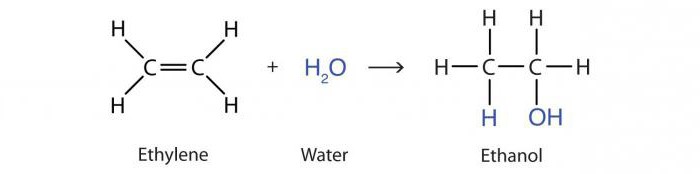
De reactie van toevoeging van water door alkenen onder invloed van zuren wordt hydratatie genoemd. Het resultaat is een propanol-2 alcoholmolecuul:
B3–HC = CH2 + H2O → CH3–OHCH - CH3.
Wanneer alkenen worden blootgesteld aan zwavelzuur, vindt het sulfoneringsproces plaats:
B3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2-OH.
De reactie vindt plaats onder vorming van zure esters, bijvoorbeeld isopropylzwavelzuur.
Alkenen zijn gevoelig voor oxidatie tijdens hun verbranding onder invloed van zuurstof om water en kooldioxidegas te vormen:
2CH3–HC = CH2 + 902 → 6CO2 + 6H2O.
De interactie van olefinische verbindingen enverdund kaliumpermanganaat in de vorm van een oplossing leidt tot de vorming van glycolen of twee atomen alcoholen. Deze reactie is ook oxidatief met de vorming van ethyleenglycol en verkleuring van de oplossing:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2 KOH.
Alkenen-moleculen kunnen worden betrokken bij het polymerisatieproces met een vrij radicaal of kation-anionisch mechanisme. In het eerste geval wordt onder invloed van peroxiden een polymeer van het polyethyleentype verkregen.
Volgens het tweede mechanisme werken zuren als kationische katalysatoren en zijn organometallische stoffen anionisch waarbij een stereoselectief polymeer vrijkomt.
Wat zijn alkanen
Ze worden ook wel paraffines of beperkend genoemdacyclische koolwaterstoffen. Ze hebben een lineaire of vertakte structuur, die alleen verzadigde enkelvoudige bindingen bevat. Alle vertegenwoordigers van de homologe reeks van deze klasse hebben de algemene formule CnX2n + 2.
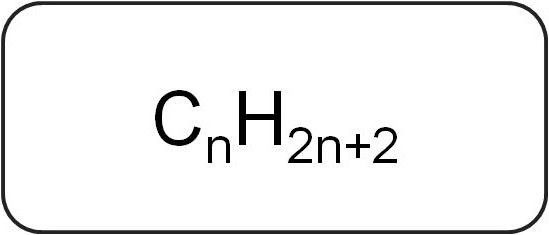
Ze bevatten alleen koolstof- en waterstofatomen. De algemene formule voor alkenen is afgeleid van de notatie van verzadigde koolwaterstoffen.
De namen van alkanen en hun kenmerken
De eenvoudigste vertegenwoordiger van deze klasseis methaan. Het wordt gevolgd door stoffen zoals ethaan, propaan en butaan. Hun naam is gebaseerd op de wortel van een getal in het Grieks, waaraan het achtervoegsel -an is toegevoegd. Alkaannamen worden vermeld in de IUPAC-nomenclatuur.
De algemene formule voor alkenen, alkynen, alkanen omvatslechts twee soorten atomen. Deze omvatten de elementen koolstof en waterstof. Het aantal koolstofatomen in alle drie de klassen is hetzelfde, het verschil wordt alleen waargenomen in het aantal waterstof, dat kan worden afgesplitst of gehecht. Onverzadigde verbindingen worden verkregen uit verzadigde koolwaterstoffen. Vertegenwoordigers van paraffinen in het molecuul bevatten 2 waterstofatomen meer dan olefinen, wat wordt bevestigd door de algemene formule van alkanen, alkenen. De alkenenstructuur wordt als onverzadigd beschouwd vanwege de aanwezigheid van een dubbele binding.
Als we het aantal waterstof- en koolstofatomen in alkanen in verband brengen, dan is de waarde maximaal in vergelijking met andere klassen koolwaterstoffen.
Beginnend met methaan en eindigend met butaan (vanaf C.1 tot C4), stoffen komen in gasvorm voor.
In vloeibare vorm, koolwaterstoffen met het homologe interval van C5 tot C16... Beginnend met een alkaan, dat 17 koolstofatomen in de hoofdketen heeft, vindt een overgang van de fysische toestand naar een vaste vorm plaats.
Ze worden gekenmerkt door isomerie in het koolstofskelet en optische modificaties van het molecuul.
Bij paraffines wordt rekening gehouden met koolstofvalentiesvolledig bezet door naburige koolstofatomen of waterstofatomen met de vorming van een σ-type binding. Vanuit chemisch oogpunt veroorzaakt dit hun zwakke eigenschappen, daarom worden alkanen verzadigde of verzadigde koolwaterstoffen genoemd, zonder affiniteit.
Ze treden in substitutiereacties in verband met radicale halogenering, sulfochlorering of nitrering van het molecuul.
Paraffines ondergaan oxidatie, verbranding of ontbinding bij hoge temperaturen. Onder invloed van reactieversnellers vindt de eliminatie van waterstofatomen of de dehydrogenering van alkanen plaats.
Wat zijn alkynen
Ze worden ook wel acetylenische koolwaterstoffen genoemd, die een drievoudige binding hebben in de koolstofketen. De structuur van alkynen wordt beschreven door de algemene formule CnX2n - 2... Hieruit blijkt dat, in tegenstelling tot alkanen, acetylenische koolwaterstoffen vier waterstofatomen missen. Ze worden vervangen door een drievoudige binding gevormd door twee π-verbindingen.
Deze structuur bepaalt de chemische eigenschappen van deze klasse. De structuurformule van alkenen en alkynen laat duidelijk de onverzadiging van hun moleculen zien, evenals de aanwezigheid van een dubbele (H2C꞊CH2) en drievoudige (HC≡CH) bindingen.
De naam van alkynen en hun kenmerken
De eenvoudigste vertegenwoordiger is acetyleenof HC≡CH. Het wordt ook wel ethine genoemd. Het komt van de naam van een verzadigde koolwaterstof, waarin het achtervoegsel -an is verwijderd en -in is toegevoegd. In de namen van lange alkynen geeft het nummer de locatie van de drievoudige binding aan.
De structuur van verzadigde enonverzadigd is het mogelijk om te bepalen onder welke letter de algemene formule van alkynen wordt aangegeven: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. De derde optie is het juiste antwoord.
Beginnend met acetyleen en eindigend met butaan (vanaf C.2 tot C4), stoffen zijn gasvormig.

In vloeibare vorm zijn er koolwaterstoffen met het homologe interval van C5 tot C17... Beginnend met alkyn, dat 18 koolstofatomen in de hoofdketen heeft, vindt een overgang van de fysische toestand plaats naar een vaste vorm.
Ze worden gekenmerkt door isomerie in het koolstofskelet, in de positie van de drievoudige binding, en door interklassemodificaties van het molecuul.
Qua chemische eigenschappen lijken acetylenische koolwaterstoffen op alkenen.
Als alkyn een terminale drievoudige binding heeft, dan zijn zefungeren als een zuur om alkynidezouten te vormen, bijvoorbeeld NaC≡CNa. De aanwezigheid van twee π-bindingen maakt het natriumacetyledine-molecuul een sterk nucleofiel dat substitutiereacties aangaat.
Acetyleen ondergaat chlorering in aanwezigheid van koperchloride om dichlooracetyleen te verkrijgen, condensatie onder invloed van halogeenalkynen met de afgifte van diacetyleenmoleculen.
Alkines zijn betrokken bij additiereactieselektrofiel, waarvan het principe de basis is van halogenering, hydrohalogenering, hydratatie en carbonylering. Dergelijke processen zijn echter zwakker dan die van alkenen met een dubbele binding.
Voor acetylenische koolwaterstoffen zijn nucleofiele additiereacties van het alcohol-, primaire amine- of waterstofsulfidemolecuul mogelijk.








