Cilvēkam visvērtīgākās ir tādas īpašības kā ozons. Ķīmiskais elements, ar ko tā veidojas, ir skābeklis O. Faktiski ozons O3 - viena no allotropic modifikācijām skābekļa,kas sastāv no trīs formulas vienībām (ОхОхО). Pirmais un vairāk zināms savienojums ir pats skābeklis, precīzāk gāze, ko veido divi tā atomi (O = O) -O2.

Allotropija ir vienas ķīmiskās vielas spējaelementu, veidojot vairākus dažādus vienkāršus savienojumus, pamatojoties uz īpašībām. Pateicoties tam, cilvēce ir pētījusi un izmanto tādas vielas kā dimantu un grafītu, monoklinisko un rombisko sēru, skābekli un ozonu. Ķīmiskais elements ar šādu spēju ne vienmēr ir ierobežots tikai ar divām izmaiņām, dažām ir vairāk.
Savienojumu vēsture
Daudzu bioloģisko un bioloģiskās daudzveidības vienību sastāvsminerālvielas, tai skaitā ozons - ķīmiskais elements, kura apzīmējums O-oxigen, no grieķu "oksi" - skāba un "gignomai" tulkojumā no dabiskām vielām.

Pirmo reizi tika izveidota jauna allotropiska skābekļa pārveidošanaEksperimentos ar elektriskām izlādēm holandietis Martin van Marun atklāja 1785. gadā, viņa uzmanību piesaistīja īpaša smarža. Un gadsimtu vēlāk frančnieks Shenbain atzīmēja to pašu klātbūtni pēc pērkona negaisa, kā rezultātā gāze tika saukta par "smaržu". Bet zinātnieki bija nedaudz maldināti, ņemot vērā to, ka viņu ozona sajūta bija ozona pati. Šķidruma smarža piederēja organiskiem savienojumiem, kas oksidēti, mijiedarbojoties ar O3, jo gāze ir ļoti reaģējoša.
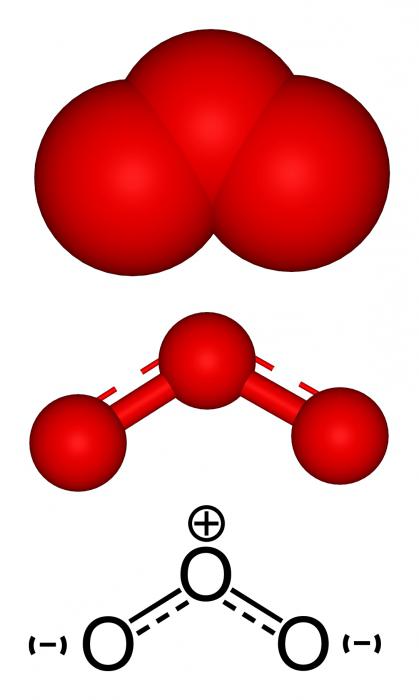
Elektroniskā struktūra
Tas pats strukturālais fragments ir O2 un O3- ķīmiskais elements. Ozonam ir sarežģītāka struktūra. Skābeklī viss ir vienkāršs - divi skābekļa atomi ir savienoti ar dubultās saites formu, kas sastāv no ϭ un π-komponenta, atkarībā no elementa valences. Par3 ir vairākas rezonējošas struktūras.
Sintēzes metodes
Lai veidotu gāzi, piemēram, ozonu, ķīmiskajam elementam oksigenam jābūt gāzveida vidē atsevišķu atomu formā. Šādus apstākļus rada skābekļa molekulu O sadursme2 ar elektriskiem izlādes elementiem vai citām daļiņām ar augstu enerģiju, kā arī tad, kad tā tiek apstarota ar ultravioleto staru.
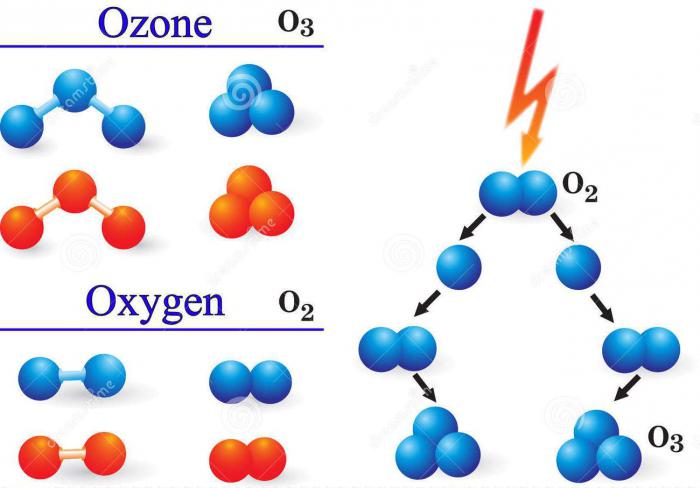
Lauvas daļa no kopējā ozonaDabas atmosfēras apstākļus veido fotoķīmiskā metode. Cilvēka dod priekšroku ķīmiskās aktivitātēs izmantot citas metodes, piemēram, elektrolīzes sintēzi. Tas sastāv no platīna elektrodu ievietošanas elektrolīta ūdens vidē un strāvas uzsākšanas. Reakcijas shēma:
H2O + O2 → Par3 + H2 + e-
Fizikālās īpašības
Oxygen (O) - vienība komponents, piemēram, ozona vielas - ķīmiskais elements, kura formula un relatīvā molārā masa ir uzskaitītas periodiskā tabula. Veidojot O3, oksigens iegūst īpašības, kas būtībā atšķiras no O īpašībām2.

Zilās krāsas gāze - tā ir parasta šāda stāvokļa stāvoklissavienojums, piemēram, ozons. Ķīmiskais elements, formula, kvantitatīvās īpašības - tas viss tika noteikts, identificējot un pētot šo vielu. Viršanas temperatūra ir -111,9 ° C, sašķidrinātā stāvoklī ir tumši violeta krāsa, turpretīgi samazinot līdz -197,2 ° C, sākas kušanas process. Cietā agregāta stāvoklī ozons iegūst melnu krāsu ar violetu nokrāsu. Tā šķīdība ir desmit reizes lielāka par skābekļa īpašību O2. Vismaz nenozīmīgākajā koncentrācijā gaisā ir jūtama ozona smarža, tā ir asa, specifiska un atgādina metāla smaku.
Ķīmiskās īpašības
Ļoti aktīvas, no reakcijas viedokļair gāzes ozons. Ķīmiskais elements, kas to veido, ir skābeklis. Īpašības, kas nosaka ozona darbību mijiedarbībā ar citām vielām, ir pašas gāzes lielā oksidēšanās spēja un nestabilitāte. Pie paaugstinātām temperatūrām tā sadalās bezprecedenta ātruma, un process paātrina tādus katalizatorus kā metālu oksīdi, hlors, slāpekļa dioksīds un citi. Oksidētāja īpašības ozonam ir raksturīgas molekulas struktūras īpatnības un viena no skābekļa atomu mobilitātei, kas, atdalot, pārvērš gāzi uz skābekli: O3 → Par2 + O
Skābeklis (ķieģelis, no kura veidotas molekulastādas vielas kā skābeklis un ozons) ir ķīmiskais elements. Kā rakstīts reakcijas vienādojumos - O ·. Ozons oksidē visus metālus, izņemot zeltu, platīnu un tā apakšgrupu. Tas reaģē ar gāzēm atmosfērā - sēra oksīdi, slāpekli un citi. Organiskās vielas neietilpst inertā veidā, jo īpaši ātri pārtraucot vairāku saišu veidošanos, veidojot starpproduktus. Ir ārkārtīgi svarīgi, lai reakcijas produkti nebūtu nekaitīgi videi un cilvēkam. Tie ir ūdens, skābeklis, dažādu elementu lielāki oksīdi, oglekļa oksīdi. Mijiedarbība ar ozonu neietver baltos kalcija, titāna un silīcija savienojumus ar skābekli.

Pieteikums
Galvenais apgabals, kurā izmanto "smaržojošo" gāziIr ozonizācija. Šī sterilizācijas metode ir daudz efektīvāka un drošāka dzīviem organismiem nekā dezinfekcija ar hloru. Kad ozons attīra ūdeni, nav toksisku metāna atvasinājumu veidošanās, kas ir aizvietoti ar bīstamu halogēnu.
Arvien vairāk šādu ekoloģisku sterilizācijas metodiatrod piedevu pārtikas rūpniecībā. Ozonu apstrādā saldēšanas iekārtas, produktu noliktavas, ar to palīdzību novērš smakas.
Medicīnā arī ozona dezinficējošās īpašības ir neaizstājamas. Viņi dezinficē brūces, fizioloģiskos šķīdumus. Ozonizē venozo asi, kā arī "smaržojošo" gāzi ārstē vairākas hroniskas slimības.
Meklējot dabu un nozīmi
Vienkārša ozona viela ir gāzes sastāvsstratosfēra, gandrīz Zemes telpas telpa, kas atrodas apmēram 20-30 km attālumā no planētas virsmas. Šī savienojuma izolēšana rodas procesu laikā, kas saistīts ar elektrisko izlādi, metināšanas laikā, Xerox mašīnu darbību. Bet stratosfērā ir izveidojusies un satur 99% no kopējā ozona daudzuma Zemes atmosfērā.
Gāzes klātbūtneZemes telpa. Tā veido tā saukto ozona slāni, kas aizsargā visu dzīvību no nāvējošā Saules ultravioletā starojuma. Par dīvaini, bet par lielu labumu gāze pati par sevi ir bīstama cilvēkiem. Ozona koncentrācijas paaugstināšanās gaisā, ko cilvēks elpo, ir kaitīga organismam, pateicoties tās ekstremālai ķīmiskai aktivitātei.









