Dvejetainiai junginiai yra medžiagos, kurias sudaro du skirtingi cheminiai elementai. Šis terminas vartojamas neorganinių junginių kokybinei ir kiekybinei sudėčiai žymėti.
Dvejetainiai cheminiai junginiai laikomi svarbiaisobjektas tiriant medžiagų pobūdį. Apibūdinant juos, vartojamos šios sąvokos: jungčių poliarizacija, oksidacijos būsena, valentingumas. Šie cheminiai terminai leidžia suprasti cheminio ryšio atsiradimo esmę, neorganinių medžiagų struktūrines ypatybes.
Apsvarstykite pagrindines dvejetainių junginių klases, jų cheminės struktūros ir savybių ypatybes bei kai kurias pramoninio taikymo sritis.

Oksidai
Ši neorganinių medžiagų klasė yra labiausiai paplitusi gamtoje. Tarp žinomų šios junginių grupės atstovų mes pabrėžiame:
- silicio oksidas (upės smėlis);
- vandenilio oksidas (vanduo);
- anglies dioksidas;
- molis (aliuminio oksidas);
- geležies rūda (geležies oksidai).
Tokie dvejetainiai junginiai yra sudėtingos medžiagos, kuriose būtinai yra deguonies, kurio oksidacijos būsena yra -2.
Suminė oksidų būsena
Vario, kalcio, geležies junginiai yrakristalinės kietosios medžiagos. Kai kurių nemetalų oksidai turi tą pačią agregacijos būseną, pavyzdžiui, šešiavalentę sierą, penkiavalentį fosforą, silicį. Skystis normaliomis sąlygomis yra vanduo. Didžioji dauguma nemetalų deguonies junginių yra dujos.
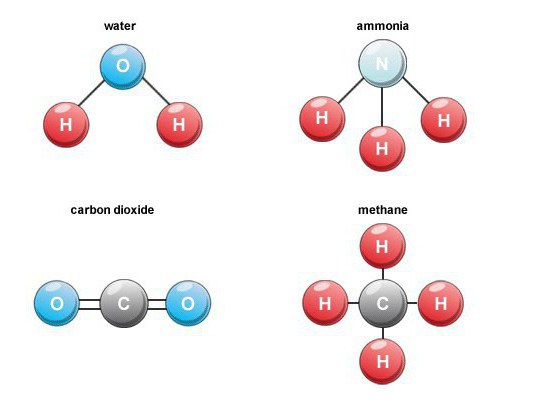
Švietimo ypatybės
Susidaro daug dvejetainių deguonies junginiųgamtoje. Pavyzdžiui, deginant kurą, kvėpavimas, organinių medžiagų irimas, susidaro anglies dioksidas (anglies monoksidas 4). Ore jo tūrinis kiekis yra apie 0,03 proc.
Panašūs dvejetainiai junginiai yra produktaiugnikalnių aktyvumas, taip pat neatskiriama mineralinio vandens dalis. Anglies dioksidas nepalaiko degimo, todėl šis cheminis junginys naudojamas gaisrams gesinti.
Lakieji vandenilio junginiai
Tokie dvejetainiai junginiai yra svarbi grupėmedžiagos, kuriose yra vandenilio. Tarp pramoninės svarbos atstovų pastebime metaną, vandenį, vandenilio sulfidą, amoniaką, taip pat vandenilio halogenidus.
Dalis lakiųjų vandenilio junginių yra dirvožemio vandenyse, gyvuose organizmuose, todėl galime kalbėti apie jų geocheminį ir biocheminį vaidmenį.
Norint sudaryti dvejetainius šio tipo junginius, pirmiausia yra vandenilis, turintis valentą. Antrasis elementas yra nemetalas, turintis neigiamą oksidacijos būseną.
Norėdami sutvarkyti indeksus dvejetainiu sujungimumažiausias bendras kartotinis nustatomas tarp valentų. Kiekvieno elemento atomų skaičius nustatomas dalijant jį iš kiekvieno junginio elemento valentingumo.

Vandenilio chloridas
Apsvarstykite dvejetainių junginių formules: vandenilio chloridas ir amoniakas. Būtent šios medžiagos yra svarbios šiuolaikinei chemijos pramonei. HCl normaliomis sąlygomis yra dujinis junginys, gerai tirpstantis vandenyje. Ištirpinus vandenilio chlorido dujas, susidaro druskos rūgštis, kuri naudojama daugelyje cheminių procesų ir pramoninių grandinių.
Šis dvinaris junginys yra žmonių ir gyvūnų skrandžio sultyse, tai yra barjeras patogeniniams mikrobams, kurie su maistu prasiskverbia į skrandį.
Tarp pagrindinių druskos rūgšties taikymo sričių išskiriame chloridų gamybą, chloro turinčių produktų sintezę, metalų ofortą, vamzdžių valymą nuo oksidų ir karbonatų bei odos gamybą.
Amoniakas, kurio formulė NH3yra bespalvės dujosspecifinis aštrus kvapas. Neribotas jo tirpumas vandenyje leidžia gauti amoniako, kurio paklausa yra medicinoje. Gamtoje šis dvinaris junginys susidaro irstant organiniams produktams, kuriuose yra azoto.

Oksido klasifikacija
Deguonis turintis dvejetainis metalo junginys, kurio valentingumas yra 1 arba 2, yra pagrindinis oksidas. Pavyzdžiui, šiai grupei priklauso šarminių ir šarminių žemių metalų oksidai.
Nemetalų oksidai, taip pat metalai, kurių valentingumas didesnis nei 4, yra rūgštiniai junginiai.
Atsižvelgiant į chemines savybes, šios klasės atstovai skirstomi į druską formuojančias ir druskos nesudarančias grupes.
Tarp tipiškų antrosios grupės atstovų pastebime anglies monoksidą (CO), azoto oksidą 1 (NO).
Junginių sisteminių pavadinimų formavimas
Tarp užduočių, siūlomų abiturientams, kurie praeinavalstybinis chemijos egzaminas, taip pat yra toks: „Sudarykite galimų dvejetainių sieros deguonies junginių (azoto, fosforo) molekulines formules“. Norint susidoroti su užduotimi, reikia turėti idėją ne tik apie algoritmą, bet ir apie šios neorganinių medžiagų klasės nomenklatūros ypatybes.
Formuojant dvejetainio pavadinimąjunginiai, iš pradžių formulėje nurodykite elementą, esantį dešinėje, pridedant priesagą „id“. Tada nurodykite pirmojo elemento pavadinimą. Kovalentiniams junginiams pridedami priešdėliai, pagal kuriuos galite nustatyti kiekybinį santykį tarp sudedamųjų dvejetainio junginio dalių.
Pavyzdžiui, SO3 - sieros trioksidas, N2Oh4 - azoto tetoksidas, I2CL6 - diodo heksachloridas.
Jei dvejetainiame junginyje yra cheminio elemento, kuris gali turėti skirtingas oksidacijos būsenas, oksidacijos būsena nurodoma skliausteliuose po junginio pavadinimo.
Pavyzdžiui, pavadinime skiriasi du geležies junginiai: FeCL3 - geležies oksidas (3), FeCL2 - geležies oksidas (2).
Hidridams, ypač nemetaliniams elementams, jie naudoja nereikšmingus pavadinimus. Taigi, H2O - vanduo, HCL - vandenilio chloridas, HI - vandenilio jodidas, HF - vandenilio fluorido rūgštis.

Katijonai
Teigiami tų elementų jonai, kuriesugeba suformuoti tik vieną stabilų joną, suteikia tuos pačius pavadinimus kaip ir patys simboliai. Tarp jų yra visi Mendelejevo periodinės sistemos pirmosios ir antrosios grupės atstovai.
Pavyzdžiui, natrio ir magnio katijonai turi formą: Na+, Mg2+... Pereinamieji elementai gali sudaryti kelis katijonų tipus, todėl pavadinimas turi nurodyti valentingumą, pasireiškiantį kiekvienu atskiru atveju.
Anijonai
Paprastiems (monoatominiams) ir kompleksiniams (poliaatominiams) anijonams naudojama galūnė –id.
Plačiai paplitęs tam tikro oksoanionaselementas yra priesaga -am. Žemesnės oksidacijos būsenos elemento oksoanijonui formulėje naudojama priesaga –it. Minimaliai oksidacijos būsenai naudojamas priešdėlis hypo, o didžiausiai - per-. Pavyzdžiui, jonas O2- yra oksido jonas ir O- - peroksidas.
Taip pat yra įvairių trivialių hidridų pavadinimų. Pavyzdžiui, N2X4 vadinamas hidrazinu, ir PH3 vadinamas fosfinu.
Sieros turintys oksoanionai turi šiuos pavadinimus:
- Su42- - sulfatas;
- C2Oh32- - tiosulfatas;
- NCS- - tiocianatas.
Druska
Daugelis chemijos baigiamųjų testų rodokita užduotis: "Sudaryti dvejetainių metalų junginių formules". Jei tokiuose junginiuose yra chloro, bromo, jodo anijonų, tokie junginiai vadinami halogenidais ir priklauso druskų klasei. Sudarant šių dvejetainių junginių formules, pirmiausia dedamas metalas, tada atitinkamas halogenidinis jonas.
Norint nustatyti kiekvieno elemento atomų skaičių, randamas mažiausias kartotinis tarp valentų, o dalijant gaunami indeksai.
Šie junginiai turi aukštą lydymosi temperatūrąir verdantis, geras tirpumas vandenyje, normaliomis sąlygomis jie yra kietosios medžiagos. Pavyzdžiui, jūros vandenyje yra natrio ir kalio chloridų.
Žmonės nuo senų senovės vartojo valgomąją druską. Šiuo metu šio dvejetainio junginio naudojimas neapsiriboja maisto vartojimu. Elektrolizuojant vandeninį natrio chlorido tirpalą, susidaro metalinės natrio ir chloro dujos. Šie produktai naudojami įvairiuose pramoniniuose procesuose, pavyzdžiui, natrio hidroksido, vandenilio chlorido gamybai.
Dvejetainių junginių reikšmė
Šiai grupei priklauso didžiulis skaičiusmedžiagų, todėl galime drąsiai kalbėti apie jų naudojimo mastą įvairiose žmogaus veiklos srityse. Amoniakas chemijos pramonėje naudojamas kaip pirmtakas gaminant azoto rūgštį, gaminant mineralines trąšas. Būtent šis dvejetainis junginys naudojamas smulkiajai organinei sintezei ir ilgą laiką buvo naudojamas šaldymo įrenginiuose.
Dėl unikalaus volframo karbido kietumo,šis junginys buvo pritaikytas gaminant įvairius pjovimo įrankius. Šio dvejetainio junginio cheminis inertiškumas leidžia jį naudoti agresyvioje aplinkoje: laboratorijos įrangoje, orkaitėse.
„Juoko dujos“ (azoto oksidas 1), sumaišytos su deguonimi, medicinoje naudojamos bendrai anestezijai.
Visi dvejetainiai junginiai turi kovalentinį arba joninį cheminį ryšį, molekulinę, joninę arba atominę kristalinę gardelę.

Išvada
Rengiant dvejetainių junginių formulesbūtina laikytis tam tikros veiksmų sekos. Pirmiausia įrašomas elementas, kuris turi teigiamą oksidacijos būseną (turi mažesnę neigiamą elektrinę vertę). Nustatant antrojo elemento oksidacijos būsenos vertę, iš aštuonių atimamas grupės numeris, kurioje jis yra. Jei gauti skaičiai skiriasi vienas nuo kito, nustatomas mažiausias bendras kartotinis, tada apskaičiuojami indeksai.
Be oksidų, šie junginiai apima:karbidai, silicidai, peroksidai, hidridai. Aliuminio ir kalcio karbidai naudojami laboratorinei metano ir acetileno gamybai; peroksidai chemijos pramonėje naudojami kaip stiprūs oksidatoriai.
Halogenidas, pvz., Vandenilio fluoridas (vandenilio fluoras)rūgštis), naudojama elektrotechnikoje litavimui. Tarp svarbiausių dvinarių junginių, be kurių sunku įsivaizduoti gyvų organizmų egzistavimą, pirmauja vanduo. Struktūriniai šio neorganinio junginio ypatumai išsamiai nagrinėjami mokyklos chemijos kurse. Pagal jos pavyzdį vaikinai susidaro veiksmų sekos idėją, kurdami dvejetainių junginių formules.
Apibendrindami pažymime, kad sunku rasti tokią šiuolaikinės pramonės sritį, žmogaus gyvenimo sritį, kur naudojami įvairūs dvejetainiai junginiai.