Gran parte della meccanica quantistica rimane oltre il confinecomprensione, molto sembra fantastico. Lo stesso vale per i numeri quantici, la cui natura è ancora oggi misteriosa. L'articolo descrive il concetto, i tipi e i principi generali del lavoro con loro.
Caratteristiche generali

Numeri quantici interi o semiinteri per fisicile quantità determinano tutti i tipi di valori discreti che caratterizzano i sistemi di quanti (molecola, atomo, nucleo) e particelle elementari. Il loro uso è strettamente correlato all'esistenza della costante di Planck. La discrezione dei processi che avvengono nel microcosmo riflette i numeri quantici e il loro significato fisico. Sono stati introdotti per la prima volta per descrivere le leggi che governano gli spettri di un atomo. Ma il significato fisico e la discrezione delle singole quantità sono stati rivelati solo nella meccanica quantistica.
Un insieme che definisce uno stato esaustivoquesto sistema si chiama completo. Tutti gli stati responsabili dei possibili valori di un tale insieme formano un sistema statale completo. I numeri quantici in chimica con i gradi di libertà dell'elettrone lo determinano in tre coordinate spaziali e il grado di libertà interno - lo spin.
Configurazioni degli elettroni negli atomi
L'atomo contiene un nucleo ed elettroni, traattraverso cui agiscono le forze di natura elettrostatica. L'energia aumenterà al diminuire della distanza tra il nucleo e l'elettrone. Si ritiene che l'energia potenziale sarà zero se viene rimossa all'infinito dal nucleo. Questo stato viene utilizzato come punto di riferimento. Pertanto, viene determinata l'energia relativa dell'elettrone.
Il guscio elettronico è un insieme di livelli di energia. L'appartenenza ad uno di essi è espressa dal numero quantico principale n.

Numero principale
Si riferisce a un livello di energia specifico conun insieme di orbitali, che hanno valori simili, costituito da numeri naturali: n = 1, 2, 3, 4, 5 ... Quando un elettrone passa da un livello all'altro, il numero quantico principale cambia. Va tenuto presente che non tutti i livelli sono pieni di elettroni. Quando si riempie il guscio di un atomo, viene implementato il principio della minima energia. Il suo stato in questo caso è chiamato non eccitato o basico.
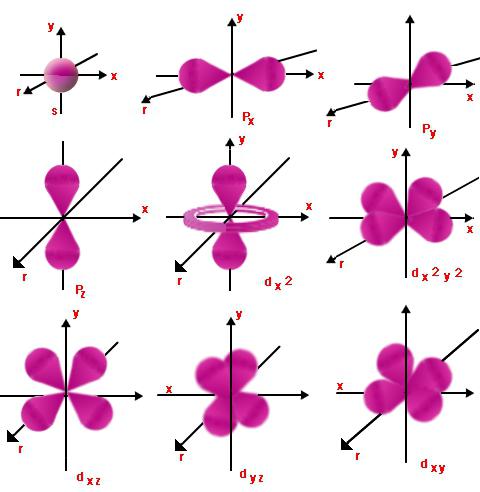
Numeri orbitali
Ogni livello ha orbitali.Quelli di loro con energia simile formano un sottolivello. Tale assegnazione viene effettuata utilizzando il numero quantico orbitale (o, come viene anche chiamato, laterale) l, che assume i valori degli interi da zero a n - 1. Quindi un elettrone avente i numeri quantici principale e orbitale n e l possono essere uguali, iniziando con l = 0 e finendo con l = n - 1.
Questo mostra la natura del movimento dei rispettivisottolivello e livello energetico. Per l = 0 e qualsiasi valore di n, la nuvola di elettroni avrà la forma di una sfera. Il suo raggio sarà direttamente proporzionale a n. A l = 1, la nuvola di elettroni assumerà la forma dell'infinito o della figura otto. Maggiore è il valore di l, più complessa diventerà la forma e l'energia dell'elettrone aumenterà.
Numeri magnetici
Ml è la proiezione dell'orbitale (lato)momento angolare nell'una o nell'altra direzione del campo magnetico. Mostra l'orientamento spaziale di quegli orbitali per i quali il numero di l è lo stesso. Ml può avere valori diversi 2l + 1, da -l a + l.
Un altro numero quantico magnetico è chiamatospin - ms, che è il momento proprio del numero di moto. Per capirlo, si può immaginare la rotazione dell'elettrone, per così dire, attorno al proprio asse. Ms può essere -1/2, +1/2, 1.
In generale, per qualsiasi elettrone, il valore assoluto dello spin è s = 1/2, e ms significa la sua proiezione sull'asse.
Principio di Pauli: un atomo non può contenere due elettroni con 4 numeri quantici simili. Almeno uno di loro dovrebbe essere fantastico.
La regola di elaborare le formule degli atomi.
- Il principio della minima energia. Su di esso, i livelli e i sottolivelli, che si trovano più vicini al nucleo, vengono prima riempiti, secondo le regole di Klechkovsky.
- La posizione dell'elemento indica come gli elettroni sono distribuiti tra i livelli e sottolivelli di energia:
- il numero coincide con la carica dell'atomo e il numero dei suoi elettroni;
- il numero periodico corrisponde al numero di livelli energetici;
- il numero di gruppo coincide con il numero di elettroni di valenza nell'atomo;
- il sottogruppo mostra la loro distribuzione.

Particelle elementari e nuclei
Numeri quantici nella fisica delle particellesono le loro caratteristiche interne che determinano interazioni e modelli di trasformazione. Oltre allo spin s, questa è la carica elettrica Q, che per tutte le particelle elementari è zero o un numero intero, negativo o positivo; carica barionica B (in una particella - zero o uno, in un'antiparticella - zero o meno uno); cariche di leptone, dove Le e Lm sono uguali a zero, uno e nell'antiparticella - zero e meno uno; spin isotopico con un intero o un semiintero; stranezza S e altri. Tutti questi numeri quantici si applicano sia alle particelle elementari che ai nuclei atomici.
Nel senso più ampio del termine, sono chiamati fisicigrandezze che determinano il moto di una particella o di un sistema e che si conservano. Tuttavia, non è affatto necessario che appartengano a uno spettro discreto di tutti i valori possibili.









