Binaariset yhdisteet ovat aineita, jotka muodostuvat kahdesta eri kemiallisesta alkuaineesta. Tätä termiä käytetään kuvaamaan epäorgaanisten yhdisteiden laadullista ja määrällistä koostumusta.
Binaarisia kemiallisia yhdisteitä pidetään tärkeinäesine aineiden luonnetta tutkittaessa. Niitä kuvattaessa käytetään seuraavia käsitteitä: sidoksen polarisaatio, hapettumistila, valenssi. Näiden kemiallisten termien avulla on mahdollista ymmärtää kemiallisen sidoksen muodostumisen ydin, epäorgaanisten aineiden rakenteelliset piirteet.
Harkitse binääristen yhdisteiden pääluokkia, niiden kemiallisen rakenteen ja ominaisuuksien ominaisuuksia sekä joitain niiden teollisen käytön alueita.

Oksidit
Tämä epäorgaanisten aineiden luokka on luonteeltaan yleisin. Tämän yhdisteryhmän tunnettujen edustajien joukossa korostamme:
- piioksidi (jokihiekka);
- vetyoksidi (vesi);
- hiilidioksidi;
- savi (alumiinioksidi);
- rautamalmi (rautaoksidit).
Tällaiset binaariset yhdisteet ovat monimutkaisia aineita, jotka välttämättä sisältävät happea, jonka hapetustila on -2.
Oksidien yhteenlaskettu tila
Kuparin, kalsiumin, raudan yhdisteet ovatkiteiset kiinteät aineet. Joidenkin ei-metallien oksideilla on sama aggregaatiotila, esimerkiksi kuusiarvoinen rikki, viisiarvoinen fosfori, pii. Nestettä normaaleissa olosuhteissa on vettä. Suurin osa ei-metallien happiyhdisteistä on kaasuja.
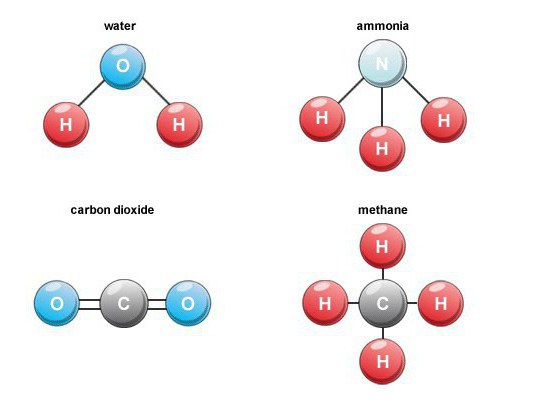
Koulutuksen piirteet
Muodostuu monia binaarisia happiyhdisteitäluonnossa. Esimerkiksi polttoaineen palamisen aikana hengitys, orgaanisen aineen hajoaminen, hiilidioksidi (hiilimonoksidi 4) muodostuu. Ilmassa sen tilavuuspitoisuus on noin 0,03 prosenttia.
Samanlaiset binääriset yhdisteet ovat tuotteitatulivuoren aktiivisuus sekä olennainen osa kivennäisvettä. Hiilidioksidi ei tue palamista, joten tätä kemiallista yhdistettä käytetään tulipalojen sammuttamiseen.
Haihtuvat vetyyhdisteet
Tällaiset binääriset yhdisteet ovat tärkeä ryhmäaineet, jotka sisältävät vetyä. Teollisuuden kannalta merkittävien edustajien joukossa on metaani, vesi, rikkivety, ammoniakki ja vetyhalogenidit.
Osa haihtuvista vetyyhdisteistä on läsnä maaperässä, elävissä organismeissa, joten voimme puhua niiden geokemiallisesta ja biokemiallisesta roolista.
Tämän tyyppisten binaaristen yhdisteiden muodostamiseksi ensinnäkin asetetaan vety, jolla on valenssi. Toinen elementti on ei-metalli, jolla on negatiivinen hapetustila.
Indeksien järjestäminen binääriliitokseksivähiten yhteinen kerroin määritetään valenssien välillä. Kunkin elementin atomien lukumäärä määritetään jakamalla se yhdisteen kunkin elementin valenssilla.

Vetykloridi
Harkitse binääristen yhdisteiden kaavoja:kloorivety ja ammoniakki. Nämä aineet ovat tärkeitä nykyaikaiselle kemianteollisuudelle. HCl on normaaleissa olosuhteissa kaasumainen yhdiste, joka liukenee hyvin veteen. Vetykloridikaasun liuottamisen jälkeen muodostuu suolahappo, jota käytetään monissa kemiallisissa prosesseissa ja teollisissa ketjuissa.
Tätä binaarista yhdistettä löytyy ihmisten ja eläinten mahalaukun mehusta, se on este patogeenisille mikrobeille, jotka pääsevät mahaan ruoan kanssa.
Kloorivetyhapon tärkeimmistä käyttöalueista korostamme kloridien tuotantoa, klooripitoisten tuotteiden synteesiä, metallien syövyttämistä, putkien puhdistamista oksideista ja karbonaateista sekä nahan tuotantoa.
Ammoniakki, jolla on kaava NH3, on väritön kaasuerityinen pistävä haju. Sen rajoittamaton liukoisuus veteen mahdollistaa ammoniakin saamisen, mikä on lääketieteessä kysyntää. Luonnossa tämä binaarinen yhdiste muodostuu orgaanisten tuotteiden hajoamisen aikana, jotka sisältävät typpeä.

Oksidien luokitus
Happea sisältävä binaarinen yhdiste metallista, jonka valenssi on 1 tai 2, on emäksinen oksidi. Esimerkiksi tähän ryhmään kuuluvat alkali- ja maa-alkalimetallien oksidit.
Ei-metallien oksidit sekä metallit, joiden valenssi on yli 4, ovat happamia yhdisteitä.
Kemiallisten ominaisuuksien mukaan tämän luokan edustajat on jaettu suolaa muodostaviin ja ei-suolaa muodostaviin ryhmiin.
Toisen ryhmän tyypillisten edustajien joukossa mainitaan hiilimonoksidi (CO), typpioksidi 1 (NO).
Yhdisteiden systemaattisten nimien muodostaminen
Niistä tehtävistä, joita tarjotaan läpäiseville tutkinnon suorittaneillekemian valtion tentti, on myös tämä: "Määritä molekyylikaavat mahdollisista rikin (typpi, fosfori) binäärisistä happiyhdisteistä." Tehtävän selviytymiseksi on oltava idea paitsi algoritmista myös tämän epäorgaanisten aineiden luokan nimikkeistön ominaisuuksista.
Muodostettaessa binäärin nimeäYhdisteet, merkitse aluksi elementti, joka sijaitsee kaavassa oikealla, lisäämällä loppuliite "id". Määritä seuraavaksi ensimmäisen elementin nimi. Kovalenttisille yhdisteille lisätään etuliitteet, joiden mukaan voit määrittää kvantitatiivisen suhteen binäärisen yhdisteen osien välillä.
Esimerkiksi SO3 - rikkitrioksidi, N2oi4 - dityppitetroksidi, I2SL6 - diodiheksakloridi.
Jos binäärisessä yhdisteessä on kemiallinen alkuaine, jolla voi olla erilaisia hapetustiloja, hapetustila ilmoitetaan sulkeissa yhdisteen nimen jälkeen.
Esimerkiksi kaksi rautayhdistettä eroavat toisistaan nimellä: FeCL3 - rautaoksidi (3), FeCL2 - rautaoksidi (2).
Hydrideille, erityisesti ei-metallisille alkuaineille, ne käyttävät triviaalia nimiä. Joten, H2O - vesi, HCL - kloorivety, HI - vetyjodidi, HF - fluorivetyhappo.

Kationit
Positiivisia ioneja niistä elementeistä, jotkapystyvät muodostamaan vain yhden vakaan ionin, antavat samat nimet kuin itse symbolit. Näihin kuuluvat kaikki Mendelejevin jaksollisen järjestelmän ensimmäisen ja toisen ryhmän edustajat.
Esimerkiksi natrium- ja magnesiumkationit ovat muotoa: Na+, Mg2+... Siirtymäelementit pystyvät muodostamaan useita kationityyppejä; siksi nimen on ilmoitettava kussakin yksittäisessä tapauksessa ilmenevä valenssi.
Anionit
Yksinkertaisten (monoatomisten) ja monimutkaisten (polyatomisten) anionien tapauksessa käytetään loppuliitettä –id.
Erään laajan oxoanioninelementti on loppuliite -am. Kaavassa matalamman hapetustilan alkuaineen oksoanionille käytetään loppuliitettä –it. Pienimmälle hapetustilalle käytetään etuliitettä hypo ja suurimmalle arvolle etuliitettä. Esimerkiksi ioni O2- on oksidi-ioni ja O- - peroksidi.
Hydrideille on myös erilaisia triviaalisia nimiä. Esimerkiksi N2X4 kutsutaan hydratsiiniksi ja PH3 kutsutaan fosfiiniksi.
Rikkiä sisältävillä oksoanioneilla on seuraavat nimet:
- CO42- - sulfaatti;
- C2oi32- - tiosulfaatti;
- NCS- - tiosyanaatti.
Suola
Monet kemian lopputestit viittaavat siihenseuraava tehtävä: "Tee kaavat binaarisia metalliyhdisteitä varten." Jos tällaiset yhdisteet sisältävät kloorin, bromin, jodin anioneja, tällaisia yhdisteitä kutsutaan halideiksi ja ne kuuluvat suolaluokkaan. Näiden binaaristen yhdisteiden kaavoja laadittaessa laitetaan ensin metalli, sitten vastaava halogenidi-ioni.
Kunkin elementin atomien lukumäärän määrittämiseksi löytyy pienin valenssien välinen moninkertainen luku, ja jaettaessa saadaan indeksit.
Näillä yhdisteillä on korkea sulamispisteja kiehuva, hyvä liukoisuus veteen, normaaleissa olosuhteissa ne ovat kiinteitä aineita. Esimerkiksi merivedestä löytyy natrium- ja kaliumkloridia.
Ihmiset ovat käyttäneet pöytäsuolaa muinaisista ajoista lähtien.Tällä hetkellä tämän binäärisen yhdisteen käyttö ei rajoitu elintarvikkeiden kulutukseen. Natriumkloridin vesiliuoksen elektrolyysi tuottaa metallista natriumia ja kaasumaista klooria. Näitä tuotteita käytetään erilaisissa teollisissa prosesseissa, esimerkiksi natriumhydroksidin, kloorivedyn tuottamiseen.
Binaaristen yhdisteiden merkitys
Tähän ryhmään kuuluu valtava määräaineista, joten voimme luotettavasti puhua niiden käytön laajuudesta ihmisen toiminnan eri aloilla. Kemianteollisuuden ammoniakkia käytetään edeltäjänä typpihapon valmistuksessa, mineraalilannoitteiden tuotannossa. Tätä binääristä yhdistettä käytetään hienossa orgaanisessa synteesissä ja sitä on käytetty pitkään jäähdytysyksiköissä.
Volframikarbidin ainutlaatuisen kovuuden ansiostatämä yhdiste on löytänyt sovelluksen erilaisten leikkaustyökalujen valmistuksessa. Tämän binäärisen yhdisteen kemiallinen inerttiys sallii sen käytön aggressiivisissa ympäristöissä: laboratoriolaitteet, uunit.
Hapen kanssa sekoitettua naurukaasua (typpioksidi 1) käytetään lääketieteessä yleisanestesiassa.
Kaikilla binäärisillä yhdisteillä on kovalenttinen tai ioninen kemiallinen sidos, molekyyli-, ioni- tai atomikristalli.

johtopäätös
Kun laaditaan kaavoja binääriyhdisteilleon tarpeen noudattaa tiettyä toimintajaksoa. Ensin kirjataan elementti, jolla on positiivinen hapetustila (jolla on pienempi sähköinen negatiivisuus). Määritettäessä toisen elementin hapetustilan arvo vähennetään kahdeksasta ryhmän numero, jossa se sijaitsee. Jos saadut luvut eroavat toisistaan, määritetään pienin yhteinen kerroin, sitten indeksit lasketaan.
Oksidien lisäksi näitä yhdisteitä ovatkarbidit, silidit, peroksidit, hydridit. Alumiini- ja kalsiumkarbideja käytetään metaanin ja asetyleenin laboratoriotuotantoon; peroksideja käytetään kemianteollisuudessa voimakkaina hapettimina.
Halogenidi, kuten fluorivety (fluorivetyhappo)happo), käytetään sähkötekniikassa juottamiseen. Tärkeimmistä binaarisista yhdisteistä, joita ilman on vaikea kuvitella elävien organismien olemassaoloa, vesi on lyijyssä. Tämän epäorgaanisen yhdisteen rakenteellisia ominaisuuksia tutkitaan yksityiskohtaisesti koulukemian kurssilla. Hänen esimerkkinsä mukaan kaverit saavat käsityksen toimintojen järjestyksestä laatiessaan kaavoja binäärisille yhdisteille.
Yhteenvetona voidaan todeta, että on vaikea löytää sellaista nykyaikaisen teollisuuden aluetta, ihmiselämän aluetta, missä käytetään erilaisia binaarisia yhdisteitä.