Yksinkertaisimmat orgaaniset yhdisteet ovat tyydyttyneitä ja tyydyttymättömiä hiilivetyjä. Näitä ovat alkaanien, alkyynien, alkeenien luokan aineet.
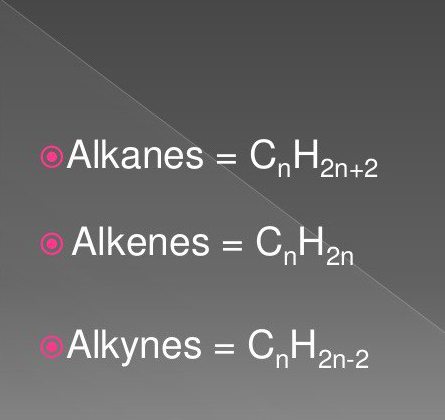
Niiden kaavat sisältävät vety- ja hiiliatomeja tietyssä sekvenssissä ja määrässä. Ne ovat luonteeltaan yleisiä.
Alkaanien määrittäminen
Heidän toinen nimi on olefiinit tai eteenihiilivedyt. Tätä kutsutaan tätä yhdisteiden luokkaa 1700-luvulla, kun öljyinen neste - etyleenikloridi - löydettiin.
Alkaanit sisältävät aineita, jotka koostuvatvety ja hiili-elementit. Ne luokitellaan asyklisiksi hiilivedyiksi. Niiden molekyylissä on yksi kaksoissidos (tyydyttymätön), joka yhdistää kaksi hiiliatomia toisiinsa.
Alkeenikaavat
Jokaisella yhdisteiden luokassa on oma kemiallinen nimityksensä. Niissä jaksollisen järjestelmän elementtien symbolit osoittavat kunkin aineen koostumuksen ja sidosrakenteen.

Alkeenien yleinen kaava on osoitettu seuraavasti: CnX2n, jossa luku n on suurempi tai yhtä suuri kuin 2. Määritettäessä sitä on selvää, että jokaiselle hiiliatomille on kaksi vetyatomia.
Homologisten alkeenien molekyylikaavoja edustavat seuraavat rakenteet: C2X4, C3X6, C4X8, C5X10, C6X12, C7X14, C8X16, C9X18, C10X20... Voidaan nähdä, että jokainen seuraava hiilivety sisältää vielä yhden hiilen ja 2 enemmän vetyä.
Molekyylissä on graafinen kuvaus kemiallisten yhdisteiden sijainnista ja järjestyksestä atomien välillä, mikä osoittaa alkeenien rakennekaavan. Valenssiviivojen avulla osoitetaan hiilien ja vetyjen välinen sidos.
Alkeenien rakennekaava voidaan kuvatalaajennetussa muodossa, kun kaikki kemialliset alkuaineet ja sidokset näkyvät. Olefiinien ytimekkäämpi ilmaisu ei osoita hiili- ja vetyyhdistettä käyttämällä valenssiviivoja.
Luuston kaava tarkoittaa yksinkertaisinta rakennetta. Katkoviiva edustaa molekyylin emästä, jossa hiiliatomeja edustavat sen yläosat ja päät, ja linkit osoittavat vetyä.
Kuinka olefiinien nimet muodostuvat
Systemaattisen nimikkeistön perusteella kaavaalkeenit ja niiden nimet koostuvat tyydyttyneisiin hiilivetyihin liittyvien alkaanien rakenteesta. Tätä varten jälkimmäisen nimessä loppuliite -an korvataan -ilen tai -en. Esimerkki on buteenin muodostuminen butaanista ja penteeni pentaanista.
Osoita arabialainen numero nimen lopussa osoittaaksesi kaksoissidoksen aseman suhteessa hiiliatomeihin.
Alkeenien nimi perustuu merkintöihinpisin ketjuinen hiilivety, jossa on kaksoissidos. Ketjunumeroinnin alkuun valitaan yleensä pää, joka on lähinnä hiiliatomien tyydyttymätöntä yhdistettä.
Jos alkeenien rakennekaavalla onhaarat, ilmoita sitten radikaalien nimet ja niiden lukumäärä, ja niiden eteen laitetaan numerot, jotka vastaavat paikkaa hiiliketjussa. Tätä seuraa itse hiilivedyn nimi. Numeroita seuraa tavuviiva.
On tyydyttymättömiä radikaaleja. Heidän nimensä voivat olla merkityksettömiä tai ne on muodostettu systemaattisen nimikkeistön sääntöjen mukaisesti.
Esimerkiksi HNC = CH- kutsutaan etenyyliksi tai vinyyliksi.
Isomeerit
Alkaanien molekyylikaavat eivät voi osoittaa isomeriaa. Tähän aineluokkaan, etyleenimolekyyliä lukuun ottamatta, tilanmuutos on kuitenkin luontaista.

Etyleenihiilivetyjen isomeerit voivat olla hiilirunko, tyydyttymätön sidosasema, luokkien välinen tai spatiaalinen.
Alkeenien yleinen kaava määrää määränhiilen ja vetyatomien ketjussa, mutta se ei osoita kaksoissidoksen läsnäoloa ja sijaintia. Esimerkki on syklopropaani C: n luokkien välisenä isomeerinä3X6 (propyleeni). Muita isomeerityyppejä esiintyy C: ssä4X8 tai buteeni.
Tyydyttymättömän yhteyden erilainen asema havaitaanbuteeni-1 tai buteeni-2, ensimmäisessä tapauksessa kaksoisyhdiste sijaitsee lähellä ensimmäistä hiiliatomia ja toisessa - ketjun keskellä. Hiilirungon isomeeria voidaan harkita käyttämällä metyylipropeenia (CH3-C (CH3= CH2) ja isobutyleeni ((CH3) 2C = CH2).
Spatiaalinen muunnos on luontainen buteeni-2: lletrans- ja cis-asema. Ensimmäisessä tapauksessa sivuradikaalit sijaitsevat päähiiliketjun ylä- ja alapuolella kaksoissidoksella, toisessa isomeerissä substituentit ovat toisella puolella.
Olefiinien karakterisointi
Alkeenien yleinen kaava määrää kaikkien tämän luokan edustajien fyysisen kunnon. Aloitetaan eteenistä ja lopetetaan butyleenistä (alk2 kohtaan C4), aineita on kaasumaisessa muodossa. Värittömällä eteenillä on siis makea haju, heikko liukoisuus veteen ja sen molekyylipaino on pienempi kuin ilman.
Nestemäisessä muodossa hiilivedyt, joiden väli on homologinen C: stä5 kohtaan C17... Alkaen alkeenista, jonka pääketjussa on 18 hiiliatomia, tapahtuu fysikaalisen tilan siirtyminen kiinteään muotoon.
Kaikkien olefiinien katsotaan olevan heikosti liukoisiavesiympäristö, mutta hyvä orgaanisissa liuottimissa, kuten bentseenissä tai bensiinissä. Niiden molekyylipaino on pienempi kuin vedellä. Hiiliketjun kasvu johtaa lämpötilaindikaattoreiden nousuun näiden yhdisteiden sulamisen ja kiehumisen aikana.
Olefiinin ominaisuudet
Alkeenien rakennekaava osoittaa läsnäolonkahden hiiliatomin π- ja σ- yhdisteiden kaksoissidoksen luuranko. Tämä molekyylin rakenne määrää sen kemialliset ominaisuudet. Π-sidoksen ei katsota olevan kovin vahva, mikä tekee mahdolliseksi sen tuhoamisen muodostamalla kaksi uutta σ-sidosta, jotka saadaan atomiparin kiinnittymisen seurauksena. Tyydyttymättömät hiilivedyt ovat elektronisia luovuttajia. He osallistuvat elektrofiilisiin kiinnitysprosesseihin.
Kaikkien alkeenien tärkeä kemiallinen ominaisuus onhalogenointiprosessi, jolloin vapautuu yhdisteitä, kuten dihalogenoituja aineita. Halogeeniatomit pystyvät kaksoissitoutumaan hiileen. Esimerkki on propeenin bromaus 1,2-dibromipropaanin muodostamiseksi:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Tämän värin neutraloinnin prosessin bromivedessä alkeenien kanssa pidetään laadullisena todisteena kaksoissidoksen läsnäolosta.
Tärkeitä reaktioita ovat olifiinien hydrauslisäämällä vetymolekyyli katalyyttisten metallien, kuten platinan, palladiumin tai nikkelin, vaikutuksesta. Tuloksena on hiilivetyjä, joissa on tyydyttynyt sidos. Alkaanien, alkeenien kaavat annetaan alla buteenin hydrauksessa:
B3–CH2–CH = CH2 + H2 Ni→ CH3–CH2–CH2–CH3.
Prosessi vetyhalidimolekyylin kiinnittämiseksi olefiineihin kutsutaan
hydrohalogenointi, joka tapahtuu säännön mukaisesti,löysi Markovnikov. Esimerkki on propeenin vetybromaus 2-bromipropaanin muodostamiseksi. Siinä vety yhdistyy kaksoissidokseen hiilen kanssa, jota pidetään eniten hydrattu:
B3–CH = CH2 + HBr → CH3–BrCH - CH3.
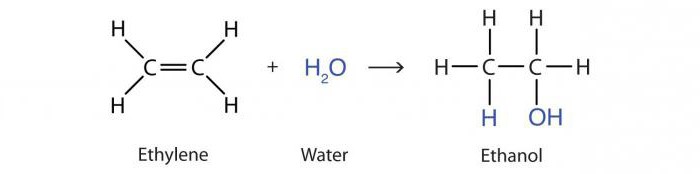
Reaktiota veden lisäyksestä alkeenien avulla happojen vaikutuksesta kutsutaan nesteytykseksi. Tuloksena on propanoli-2-alkoholimolekyyli:
B3–HC = CH2 + H2O → CH3–OHCH - CH3.
Kun alkeenit altistetaan rikkihapolle, sulfonointiprosessi tapahtuu:
B3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2- OH.
Reaktio tapahtuu muodostamalla happamia estereitä, esimerkiksi isopropyylirikkihappoa.
Alkaanit ovat alttiita hapettumiselle palamisen aikana hapen vaikutuksesta muodostaen vettä ja hiilidioksidikaasua:
2CH3–HC = CH2 + 9O2 → 6CO2 + 6H2O.
Olefiinisten yhdisteiden jalaimennettu kaliumpermanganaatti liuoksen muodossa johtaa glykolien tai piimaisten alkoholien muodostumiseen. Tämä reaktio on myös hapettava muodostamalla eteeniglykolia ja liuoksen värimuutoksia:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Alkaanimolekyylit voivat olla mukana polymeroinnissa vapaiden radikaalien tai kationi- anionisten mekanismien avulla. Ensimmäisessä tapauksessa peroksidien vaikutuksesta saadaan polyetyleenityyppinen polymeeri.
Toisen mekanismin mukaan hapot toimivat kationisina katalyytteinä, ja metalliorgaaniset aineet ovat anionisia vapauttamalla stereoselektiivinen polymeeri.
Mitä ovat alkaanit
Niitä kutsutaan myös parafiineiksi tai rajoittaviksiasykliset hiilivedyt. Niillä on lineaarinen tai haaroittunut rakenne, joka sisältää vain tyydyttyneitä yksinkertaisia sidoksia. Kaikilla tämän luokan homologisen sarjan edustajilla on yleinen kaava CnX2n + 2.
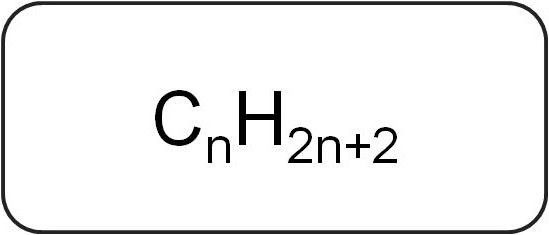
Ne sisältävät vain hiili- ja vetyatomeja. Alkeenien yleinen kaava on peräisin tyydyttyneiden hiilivetyjen merkinnöistä.
Alkaanien nimet ja niiden ominaisuudet
Tämän luokan yksinkertaisin edustajaon metaania. Sitä seuraavat aineet, kuten etaani, propaani ja butaani. Heidän nimensä perustuu kreikan kielen numeron juuriin, johon lisätään loppuliite -an. Alkaaninimet on lueteltu IUPAC-nimikkeistössä.
Alkeenien, alkyynien, alkaanien yleinen kaava sisältäävain kahdenlaisia atomeja. Näihin kuuluvat hiili ja vety. Hiiliatomien määrä kaikissa kolmessa luokassa on sama, ero havaitaan vain vedyn lukumäärässä, joka voidaan jakaa tai kiinnittää. Tyydyttymättömät yhdisteet saadaan tyydyttyneistä hiilivedyistä. Parafiinien edustajat molekyylissä sisältävät 2 vetyatomia enemmän kuin olefiinit, minkä vahvistaa alkaanien, alkeenien yleinen kaava. Alkaanirakennetta pidetään tyydyttämättömänä kaksoissidoksen läsnäolon vuoksi.
Jos verrataan vety- ja hiiliatomien määrää alkaaneissa, arvo on suurin verrattuna muihin hiilivetyryhmiin.
Aloitetaan metaanilla ja lopetetaan butaanilla (C: stä)1 kohtaan C4), aineita on kaasumaisessa muodossa.
Nestemäisessä muodossa hiilivedyt, joiden väli on homologinen C: stä5 kohtaan C16... Alkaen alkaanista, jonka pääketjussa on 17 hiiliatomia, tapahtuu fysikaalisen tilan siirtyminen kiinteään muotoon.
Niille on ominaista isomerismi hiilirungossa ja molekyylin optiset modifikaatiot.
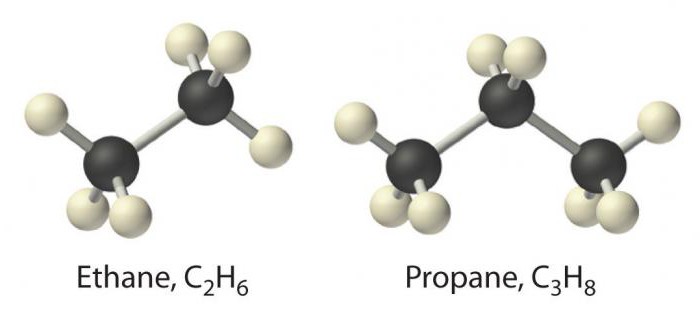
Parafiineissa otetaan huomioon hiilivalenssitnaapurihiilien tai vetyjen kokonaan miehittämä ja muodostuu σ-tyyppinen sidos. Kemiallisesta näkökulmasta tämä aiheuttaa niiden heikkoja ominaisuuksia, minkä vuoksi alkaaneja kutsutaan tyydyttyneiksi tai tyydyttyneiksi hiilivedyiksi, vailla affiniteettia.
Ne alkavat substituutioreaktioista, jotka liittyvät molekyylin radikaaliseen halogenointiin, sulfoklooriin tai nitraukseen.
Parafiinit hapettuvat, palavat tai hajoavat korkeissa lämpötiloissa. Reaktiokiihdyttimien vaikutuksesta vetyatomit eliminoituvat tai alkaanit dehydratoidaan.
Mitä ovat alkyynejä
Niitä kutsutaan myös asetyleenihiilivedeiksi, joilla on kolmoissidos hiiliketjussa. Alkyynien rakenne kuvataan yleiskaavalla CnX2n - 2... Siitä voidaan nähdä, että toisin kuin alkaanit, asetyleenihiilivedyistä puuttuu neljä vetyatomia. Ne korvataan kolmoissidoksella, jonka muodostavat kaksi π-yhdistettä.
Tämä rakenne määrittää tämän luokan kemialliset ominaisuudet. Alkeeenien ja alkyynien rakennekaava osoittaa selvästi niiden molekyylien tyydyttymättömyyden sekä kaksois- (H2C꞊CH2) ja kolmoissidokset (HC2CH).
Alkyynien nimi ja niiden ominaisuudet
Yksinkertaisin edustaja on asetyleenitai HC2CH. Sitä kutsutaan myös etiiniksi. Se tulee kyllästetyn hiilivedyn nimestä, johon loppu -an poistetaan ja -in lisätään. Pitkien alkyynien nimissä numero osoittaa kolmoissidoksen sijainnin.
Tyydyttyneiden jatyydyttymättömänä on mahdollista määrittää, minkä kirjaimen alla alkyynien yleinen kaava on osoitettu: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Kolmas vaihtoehto on oikea vastaus.
Aloitetaan asetyleenistä ja lopetetaan butaanilla (C: stä)2 kohtaan C4), aineet ovat luonteeltaan kaasumaisia.

Nestemäisessä muodossa on hiilivetyjä, joiden väli on homologinen C: stä5 kohtaan C17... Alkaen alkyynistä, jonka pääketjussa on 18 hiiliatomia, tapahtuu fysikaalisen tilan siirtyminen kiinteään muotoon.
Niille on tunnusomaista isomerismi hiilirungossa, kolmoissidoksen asennossa sekä molekyylin väliset modifikaatiot.
Kemiallisten ominaisuuksien suhteen asetyleenihiilivedyt ovat samanlaisia kuin alkeenit.
Jos alkyneillä on terminaalinen kolmoissidos, niin netoimivat happona muodostaen alkynidisuoloja, esimerkiksi NaC 2CNa. Kahden π-sidoksen läsnäolo tekee natriumasetyylidiinimolekyylistä vahvan nukleofiilin, joka siirtyy substituutioreaktioihin.
Asetyleeni kloorataan kuparikloridin läsnä ollessa diklooriasetyleenin saamiseksi. Kondensoituu halogeenialkynien vaikutuksesta diasetyleenimolekyylien vapautuessa.
Alkiinit ovat mukana additioreaktioissaelektrofiilinen, jonka periaate on halogenoinnin, hydrohalogenoinnin, hydraation ja karbonyloinnin perusta. Tällaiset prosessit ovat kuitenkin heikompia kuin kaksoissidoksen sisältävien alkeenien.
Asetyleenihiilivedyille alkoholin, primaarisen amiinin tai rikkivetymolekyylin nukleofiiliset additioreaktiot ovat mahdollisia.








