Cada alumno se enfrenta en las lecciones de física conun concepto como "calor específico". En la mayoría de los casos, las personas olvidan la definición de escuela y, a menudo, no comprenden el significado de este término en absoluto. En las universidades técnicas, la mayoría de los estudiantes se enfrentarán tarde o temprano a la capacidad calorífica específica. Quizás en el marco del estudio de la física, o quizás alguien tenga una disciplina como "ingeniería térmica" o "termodinámica técnica". En este caso, deberá recordar el plan de estudios de la escuela. Entonces, a continuación se muestra la definición, ejemplos y valores para algunas sustancias.
Definición
El calor específico es físicouna cantidad que caracteriza cuánto calor debe suministrarse a una unidad de materia o eliminarse de una unidad de materia para que su temperatura cambie un grado. Es importante cancelar, que no importa, grados Celsius, Kelvin y Fahrenheit, lo principal es el cambio de temperatura en uno.
El calor específico tiene su propia unidadmedidas - en el sistema internacional de unidades (SI) - Joule dividido por el producto del kilogramo y el grado Kelvin, J / (kg · K); La unidad fuera del sistema es la relación entre las calorías y el producto de kilogramos y grados Celsius, cal / (kg · ° C). Este valor se indica con mayor frecuencia con la letra c o C, a veces se utilizan índices. Por ejemplo, si la presión es constante, entonces el índice es p, y si el volumen es constante, entonces v.
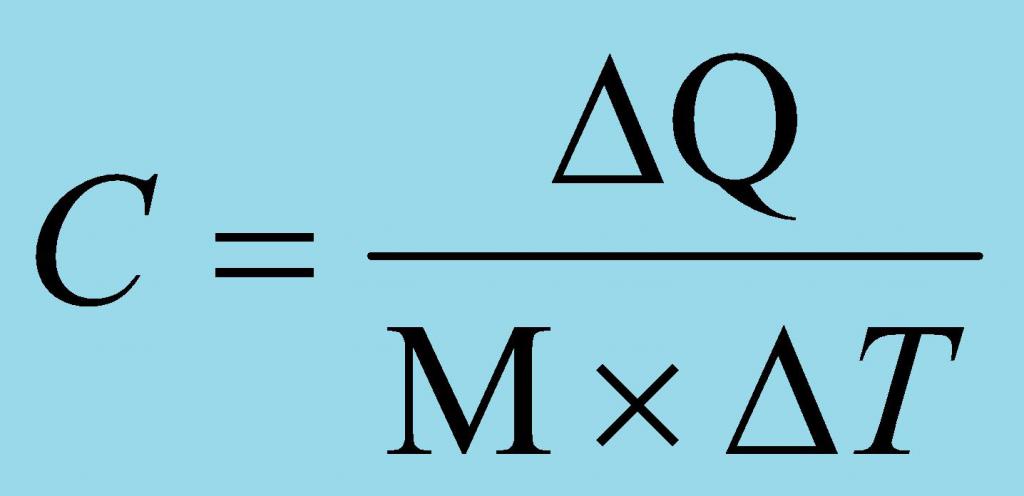
Variaciones de definición
Son posibles varias definicionesdiscutió la cantidad física. Además de lo anterior, se considera aceptable una definición, que establece que el calor específico es la relación entre la capacidad calorífica de una sustancia y su masa. En este caso, es necesario comprender claramente qué es la "capacidad calorífica". Entonces, la capacidad calorífica es una cantidad física que muestra cuánto calor debe suministrarse a un cuerpo (sustancia) o eliminarse para cambiar el valor de su temperatura en uno. La capacidad calorífica específica de la masa de una sustancia superior a un kilogramo se determina de la misma forma que para un valor único.
Algunos ejemplos y significados de varias sustancias.

Se ha encontrado experimentalmente que para diferentes sustanciaseste significado es diferente. Por ejemplo, la capacidad calorífica específica del agua es 4,187 kJ / (kg · K). El valor más grande de esta cantidad física para el hidrógeno es 14.300 kJ / (kg K), el más pequeño para el oro es 0.129 kJ / (kg K). Si necesita un valor para una sustancia específica, debe tomar un libro de referencia y encontrar las tablas correspondientes, y en ellas, los valores de interés. Sin embargo, las tecnologías modernas permiten acelerar el proceso de búsqueda a veces: es suficiente en cualquier teléfono que tenga la opción de ingresar a la World Wide Web, escribir la pregunta de interés en la barra de búsqueda, iniciar la búsqueda y buscar el respuesta basada en los resultados. En la mayoría de los casos, debe seguir el primer enlace. Sin embargo, a veces no es necesario ir a ningún otro lugar; en la breve descripción de la información, puede ver la respuesta a la pregunta.

Las sustancias más comunes para las que se busca capacidad calorífica, incluida la capacidad calorífica específica, son:
- aire (seco) - 1.005 kJ / (kg K),
- aluminio - 0,930 kJ / (kg K),
- cobre - 0.385 kJ / (kg K),
- etanol - 2.460 kJ / (kg K),
- hierro - 0.444 kJ / (kg K),
- mercurio - 0,139 kJ / (kg K),
- oxígeno - 0.920 kJ / (kg K),
- madera - 1.700 kJ / (kg K),
- arena - 0.835 kJ / (kg K).












