El concepto de enlace químico tiene un importanteimportancia en varios campos de la química como ciencia. Esto se debe al hecho de que es con su ayuda que los átomos individuales pueden combinarse en moléculas, formando todo tipo de sustancias que, a su vez, son objeto de investigación química.
La variedad de átomos y moléculas está asociada con la aparición de varios tipos de enlaces entre ellos. Las diferentes clases de moléculas se caracterizan por sus propias características de distribución de electrones y, por lo tanto, sus propios tipos de enlaces.
Conceptos basicos
Enlace químico llamar al conjunto de interacciones queconducen a la unión de átomos con la formación de partículas estables de estructura más compleja (moléculas, iones, radicales), así como agregados (cristales, vidrios, etc.). La naturaleza de estas interacciones es de naturaleza eléctrica y surgen durante la distribución de los electrones de valencia en los átomos que se aproximan.
Valence aceptado nombrar la capacidad de un átomoForman un cierto número de enlaces con otros átomos. En los compuestos iónicos, el número de electrones donados o unidos se toma como valor de valencia. En compuestos covalentes, es igual al número de pares de electrones comunes.
Debajo el estado de oxidación se entiende como un condicional la carga que podría estar en un átomo si todos los enlaces covalentes polares fueran iónicos.
La multiplicidad de la comunicación se llama el número de pares de electrones compartidos entre los átomos considerados.
Los enlaces considerados en diversas ramas de la química se pueden dividir en dos tipos de enlaces químicos: los que conducen a la formación de nuevas sustancias (intramoleculares)y los que surgen entre moléculas (intermoleculares).
Características básicas de comunicación
Por la energía de la comunicación llame a la energía necesaria para romper todos los enlaces existentes en la molécula. También es la energía liberada durante la formación de un enlace.
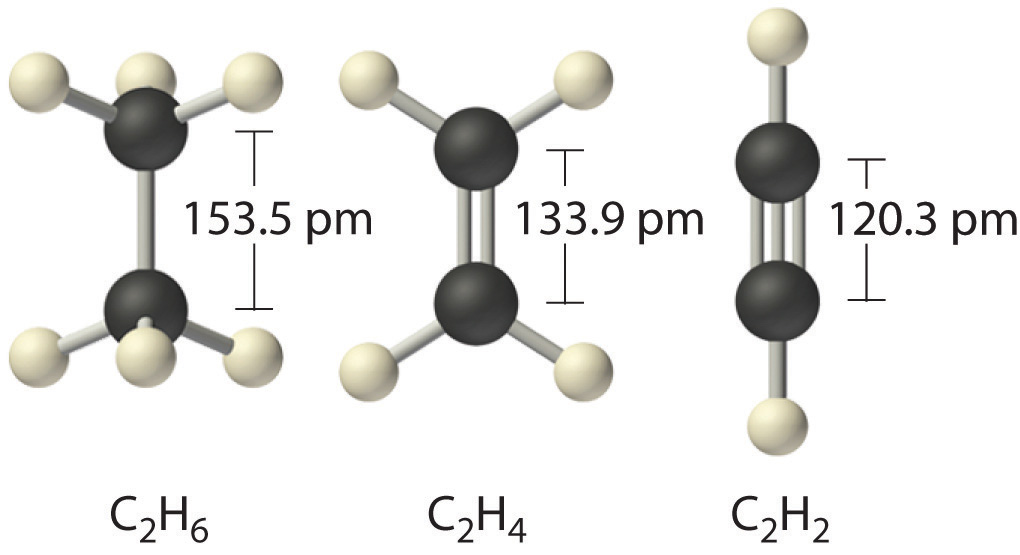
Duración de la comunicación se refiere a la distancia entre núcleos adyacentes de átomos en una molécula a la que se equilibran las fuerzas de atracción y repulsión.
Estas dos características del enlace químico de los átomos son una medida de su fuerza: cuanto más corta es la longitud y mayor es la energía, más fuerte es el enlace.
Ángulo de valencia se acostumbra llamar al ángulo entre las líneas representadas que pasan en la dirección del enlace a través de los núcleos de los átomos.
Métodos de descripción de relaciones
Los dos enfoques más comunes para explicar el enlace químico, tomados de la mecánica cuántica:
Método orbital molecular. Él ve una molécula como una colecciónelectrones y núcleos de átomos, y cada electrón individual se mueve en el campo de acción de todos los demás electrones y núcleos. La molécula tiene una estructura orbital y todos sus electrones se distribuyen a lo largo de estas órbitas. Además, este método se llama MO LCAO, que significa "orbital molecular, una combinación lineal de orbitales atómicos".
El método de los enlaces de valencia. Representa una molécula como un sistema de dos centralesorbitales moleculares. Además, cada uno de ellos corresponde a un enlace entre dos átomos adyacentes en la molécula. El método se basa en las siguientes disposiciones:
- La formación de un enlace químico se lleva a cabo por un parelectrones que tienen espines opuestos, que se encuentran entre los dos átomos considerados. El par de electrones formado pertenece a dos átomos por igual.
- El número de enlaces formados por uno u otro átomo es igual al número de electrones desapareados en el suelo y los estados excitados.
- Si los pares electrónicos no participan en la formación de un enlace, se denominan pares solitarios.
Electronegatividad
Es posible determinar el tipo de enlace químico en sustancias basándose en la diferencia en los valores de las electronegatividades de sus átomos constituyentes. Bajo electronegatividad comprender la capacidad de los átomos para extraer pares de electrones comunes (nube de electrones), lo que conduce a la polarización del enlace.
Hay varias formas de definir valoreselectronegatividades de elementos químicos. Sin embargo, la más utilizada es la escala basada en datos termodinámicos, que fue propuesta en 1932 por L. Pauling.

Cuanto mayor sea la diferencia enelectronegatividad de los átomos, más se manifiesta su ionicidad. Por el contrario, valores iguales o cercanos de electronegatividad indican la naturaleza covalente del enlace. En otras palabras, es posible determinar matemáticamente qué tipo de enlace químico se observa en una molécula en particular. Para hacer esto, necesitas calcular ΔХ - la diferencia entre las electronegatividades de los átomos por la fórmula: ΔX = | X1-X2|.
- Si ΔX> 1,7, entonces el enlace es iónico.
- Si 0.5≤ΔX≤1.7, entonces el enlace covalente es polar.
- Si ΔX = 0 o cerca de él, entonces el enlace se refiere a un covalente no polar.
Enlace iónico
Ionic es una conexión que apareceentre iones o debido a la tracción completa de un par de electrones común por uno de los átomos. En las sustancias, este tipo de enlace químico se realiza por las fuerzas de atracción electrostática.
Los iones son partículas cargadas formadas a partir deátomos como resultado de la unión o liberación de electrones. Si un átomo acepta electrones, adquiere una carga negativa y se convierte en anión. Si el átomo dona electrones de valencia, se convierte en una partícula cargada positivamente llamada catión.
Es característico de los compuestos formados eninteracción de átomos de metales típicos con átomos de no metales típicos. La parte principal de este proceso es el deseo de los átomos de adquirir configuraciones electrónicas estables. Y los metales y no metales típicos necesitan dar o recibir solo 1-2 electrones para esto, lo que hacen con facilidad.

El mecanismo de formación de un enlace químico iónico enla molécula se considera tradicionalmente en el ejemplo de la interacción del sodio y el cloro. Los átomos de metales alcalinos donan fácilmente un electrón tirado por un átomo de halógeno. Como resultado, el catión Na+ y el anión Cl-que se mantienen unidos por atracción electrostática.
No existe un enlace iónico ideal.Incluso en tales compuestos, que a menudo se denominan iónicos, no se produce la transición final de electrones de un átomo a otro. El par de electrones formado sigue siendo de uso común. Por tanto, hablan del grado de ionicidad del enlace covalente.
El enlace iónico se caracteriza por dos propiedades principales relacionadas entre sí:
- no direccionalidad, es decir, el campo eléctrico alrededor del ion tiene la forma de una esfera;
- La insaturación, es decir, el número de iones con carga opuesta que se pueden ubicar alrededor de cualquier ion, está determinada por su tamaño.
Enlace químico covalente
El vínculo formado por la superposición de componentes electrónicos.Las nubes de átomos de no metales, es decir, realizadas por un par de electrones común, se denominan enlace covalente. El número de pares de electrones compartidos determina la multiplicidad del enlace. Así, los átomos de hidrógeno están unidos por un solo enlace H ··· H, y los átomos de oxígeno forman un doble enlace O :: O.
Existen dos mecanismos para su formación:
- Intercambiable: cada átomo representa parala formación de un par común de un electrón: А
- Donante-aceptor: para la formación de un enlace, uno de los átomos (donante) proporciona un par de electrones, y el segundo (aceptor) proporciona un orbital libre para su ubicación: A +: B = A: B.

Los métodos de superposición de nubes de electrones durante la formación de un enlace químico covalente también son diferentes.
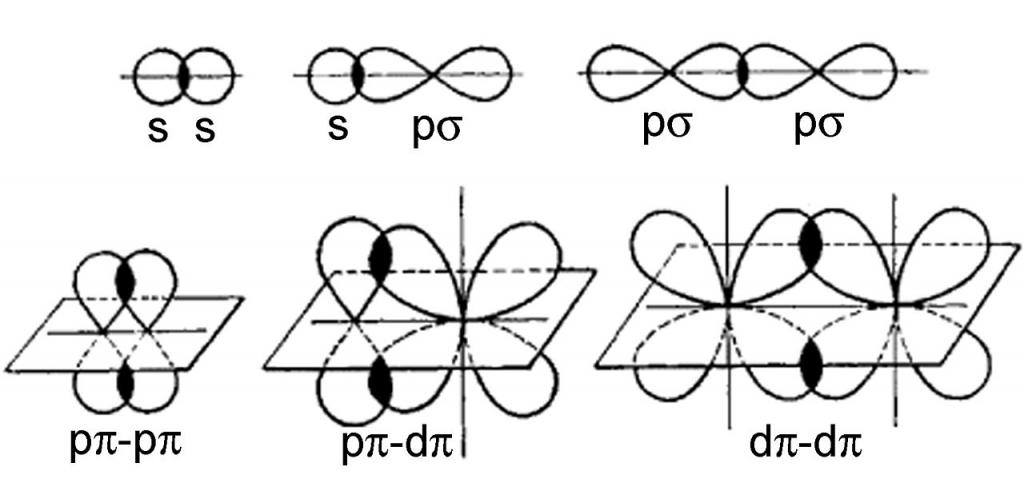
- Directo.La región de superposición de nubes se encuentra en una línea imaginaria recta que conecta los núcleos de los átomos en consideración. En este caso, se forman enlaces σ. El tipo de enlace químico que se produce en este caso depende del tipo de nubes de electrones que se superponen: enlaces s-s, s-p, p-p, s-d o p-d σ. En una partícula (molécula o ion), solo es posible un enlace σ entre dos átomos vecinos.
- Lateral.Se realiza a ambos lados de la línea que conecta los núcleos atómicos. Así es como se forma un enlace π, y sus variedades también son posibles: p-p, p-d, d-d. Aparte del enlace σ, el enlace π nunca se forma; puede estar en moléculas que contienen enlaces múltiples (dobles y triples).
Propiedades de enlace covalente
Son ellos quienes determinan la química y la físicacaracterísticas de las conexiones. Las principales propiedades de cualquier enlace químico en sustancias son su direccionalidad, polaridad y polarizabilidad, así como la saturación.
Dirección La conexión se debe a las peculiaridades de la estructura molecular.la estructura de las sustancias y la forma geométrica de sus moléculas. Su esencia es que la mejor superposición de nubes de electrones es posible con una cierta orientación en el espacio. Las variantes de formación de enlaces σ y π ya se han considerado anteriormente.
Debajo saturación comprender la capacidad de los átomos para formar un cierto número de enlaces químicos en una molécula. El número de enlaces covalentes para cada átomo está limitado por el número de orbitales externos.
Polaridad la conexión depende de la diferencia de valoreselectronegatividades de los átomos. De ello depende la uniformidad de la distribución de electrones entre los núcleos de los átomos. Un enlace covalente para este rasgo puede ser polar o no polar.
- Si un par de electrones común pertenece igualmente a cada uno de los átomos y está ubicado a la misma distancia de sus núcleos, entonces el enlace covalente es apolar.
- Si el par común de electrones se desplaza al núcleo de uno de los átomos, se forma un enlace químico polar covalente.
Polarizabilidad se expresa por el desplazamiento de los electrones de enlace bajola acción de un campo eléctrico externo, que puede pertenecer a otra partícula, enlaces vecinos en la misma molécula, o provenir de fuentes externas de campos electromagnéticos. Entonces, un enlace covalente bajo su influencia puede cambiar su polaridad.
La hibridación de orbitales se entiende como un cambio en su forma durante la implementación de un enlace químico. Esto es necesario para lograr la superposición más eficaz. Existen los siguientes tipos de hibridación:
- sp3... Un orbital sy tres orbitales p forman cuatro orbitales "híbridos" de la misma forma. Exteriormente, se parece a un tetraedro con un ángulo entre los ejes de 109 °.
- sp2... Un orbital sy dos orbitales p forman un triángulo plano con un ángulo entre los ejes de 120 °.
- sp. Un orbital s y uno p forman dos orbitales "híbridos" con un ángulo entre sus ejes de 180 °.
Enlace metálico
Una característica de la estructura de los átomos metálicos esradio bastante grande y la presencia de una pequeña cantidad de electrones en los orbitales externos. Como resultado, en tales elementos químicos, el enlace entre el núcleo y los electrones de valencia es relativamente débil y se rompe fácilmente.
Metal un enlace se denomina interacción entre átomos-iones de metales, que se lleva a cabo con la ayuda de electrones deslocalizados.
En las partículas metálicas, los electrones de valencia puedenes fácil dejar orbitales externos, como, de hecho, ocupar lugares vacíos en ellos. Así, en diferentes momentos, la misma partícula puede ser un átomo y un ión. Los electrones desprendidos de ellos se mueven libremente por todo el volumen de la red cristalina y realizan un enlace químico.

Este tipo de enlace tiene similitudes con iónico ycovalente. En cuanto al enlace iónico, los iones son necesarios para la existencia de un enlace metálico. Pero si para la implementación de la interacción electrostática en el primer caso, se necesitan cationes y aniones, en el segundo, los electrones juegan el papel de las partículas cargadas negativamente. Si comparamos un enlace metálico con un enlace covalente, entonces se requieren electrones comunes para la formación de ambos. Sin embargo, a diferencia de un enlace químico polar, no se localizan entre dos átomos, sino que pertenecen a todas las partículas metálicas de la red cristalina.
Las propiedades especiales de casi todos los metales se deben al enlace metálico:
- plasticidad, está presente debido a la posibilidad de desplazamiento de capas de átomos en la red cristalina, sostenida por el gas de electrones;
- brillo metálico, que se observa debido a la reflexión de los rayos de luz de los electrones (en un estado de polvo no hay una red cristalina y, por lo tanto, los electrones se mueven a lo largo de ella);
- conductividad eléctrica, que se lleva a cabo mediante un flujo de partículas cargadas, y en este caso, pequeños electrones se mueven libremente entre grandes iones metálicos;
- conductividad térmica, observada debido a la capacidad de los electrones para transferir calor.
Enlace de hidrógeno
Este tipo de enlace químico a veces se llamaintermedio entre interacciones covalentes e intermoleculares. Si un átomo de hidrógeno tiene un enlace con uno de los elementos fuertemente electronegativos (como fósforo, oxígeno, cloro, nitrógeno), entonces puede formar un enlace adicional llamado hidrógeno.
Es mucho más débil que todos los tipos de enlaces considerados anteriormente (energía que no excede los 40 kJ / mol), pero no se puede descuidar. Es por eso que el enlace químico de hidrógeno en el diagrama parece una línea de puntos.

La formación de un enlace de hidrógeno es posible debido ainteracción electrostática donante-aceptor simultáneamente. Una gran diferencia en los valores de electronegatividad conduce a la aparición de un exceso de densidad de electrones en los átomos de O, N, F y otros, así como a su ausencia en el átomo de hidrógeno. En el caso de que no exista un enlace químico entre dichos átomos, cuando están suficientemente cerca, se activan las fuerzas de atracción. En este caso, el protón es el aceptor del par de electrones y el segundo átomo es el donante.
Un enlace de hidrógeno puede surgir tanto entre moléculas adyacentes, por ejemplo, agua, ácidos carboxílicos, alcoholes, amoníaco, como dentro de una molécula, por ejemplo, ácido salicílico.
La presencia de un enlace de hidrógeno entre las moléculas de agua explica varias de sus propiedades físicas únicas:
- Los valores de su capacidad calorífica, dieléctricola permeabilidad, los puntos de ebullición y fusión, de acuerdo con los cálculos, deben ser significativamente más bajos que los reales, lo que se explica por la conexión de las moléculas y la necesidad de gastar energía para romper los enlaces de hidrógeno intermoleculares.
- A diferencia de otras sustancias, al bajartemperatura, el volumen de agua aumenta. Esto se debe al hecho de que las moléculas ocupan una determinada posición en la estructura cristalina del hielo y se alejan unas de otras a lo largo del enlace de hidrógeno.
Esta conexión juega un papel especial para los vivos.organismos, ya que su presencia en moléculas de proteínas determina su estructura especial y, por tanto, sus propiedades. Además, los ácidos nucleicos, que forman la doble hélice del ADN, también están unidos por enlaces de hidrógeno.
Bonos de cristal
La gran mayoría de sólidos tienencelosía cristalina: una disposición mutua especial de las partículas que las forman. En este caso, se observa una periodicidad tridimensional, y los átomos, moléculas o iones se ubican en los nodos, los cuales están conectados por líneas imaginarias. Dependiendo de la naturaleza de estas partículas y los enlaces entre ellas, todas las estructuras cristalinas se dividen en atómicas, moleculares, iónicas y metálicas.
Los sitios de la red cristalina iónica soncationes y aniones. Además, cada uno de ellos está rodeado por un número estrictamente definido de iones con solo cargas opuestas. Un ejemplo típico es el cloruro de sodio (NaCl). Tienden a tener altos puntos de fusión y dureza, ya que requieren mucha energía para descomponerse.
En los sitios de la red cristalina molecular hay moléculas de sustancias formadas por un enlace covalente (por ejemplo, I2). Están conectados entre sí por una interacción débil de van der Waals y, por lo tanto, esta estructura es fácil de destruir. Dichos compuestos tienen puntos de fusión y de ebullición bajos.
La red cristalina atómica está formada por átomos.elementos químicos con valores de valencia elevados. Están conectados por fuertes enlaces covalentes, lo que significa que las sustancias tienen altos puntos de ebullición, puntos de fusión y gran dureza. Un ejemplo es un diamante.
Así, todos los tipos de enlaces disponibles enLos productos químicos tienen sus propias características, que explican las sutilezas de la interacción de partículas en moléculas y sustancias. Las propiedades de las conexiones dependen de ellas. Determinan todos los procesos que ocurren en el medio ambiente.








