Proteine sind eines der wichtigsten organischen Elementejede lebende Zelle des Körpers. Sie erfüllen viele Funktionen: Unterstützung, Signalisierung, Enzym-, Transport-, Struktur-, Rezeptor- usw. Primär-, Sekundär-, Tertiär- und Quartärstrukturen von Proteinen sind zu einer wichtigen evolutionären Anpassung geworden. Woraus bestehen diese Moleküle? Warum ist die korrekte Konformation von Proteinen in den Körperzellen so wichtig?
Strukturkomponenten von Proteinen
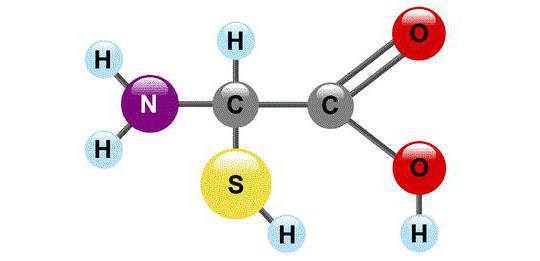
Monomere einer beliebigen Polypeptidkette sindAminosäuren (AA). Diese niedermolekularen organischen Verbindungen sind in der Natur weit verbreitet und können als unabhängige Moleküle existieren, die ihre inhärenten Funktionen erfüllen. Darunter der Transport von Substanzen, die Aufnahme, Hemmung oder Aktivierung von Enzymen.
Insgesamt gibt es etwa 200 biogeneAminosäuren können jedoch nur 20 davon Proteinmonomere sein. Sie lösen sich leicht in Wasser, haben eine kristalline Struktur und viele von ihnen haben einen süßen Geschmack.

Aus chemischer Sicht ist AK ein Molekül indie notwendigerweise zwei funktionelle Gruppen enthalten: -COOH und -NH2. Mit Hilfe dieser Gruppen bilden Aminosäuren Ketten, die durch eine Peptidbindung miteinander verbunden sind.
Jede der 20 proteinogenen Aminosäuren hat ein eigenes Radikal, je nachdem, welche chemischen Eigenschaften unterschiedlich sind. Entsprechend der Zusammensetzung solcher Radikale werden alle AAs in mehrere Gruppen eingeteilt.
- Unpolar: Isoleucin, Glycin, Leucin, Valin, Prolin, Alanin.
- Polar und ungeladen: Threonin, Methionin, Cystein, Serin, Glutamin, Asparagin.
- Aromatisch: Tyrosin, Phenylalanin, Tryptophan.
- Polar und negativ geladen: Glutamat, Aspartat.
- Polar und positiv geladen: Arginin, Histidin, Lysin.
Jede Ebene der Organisation der Proteinstruktur(primär, sekundär, tertiär, quaternär) basiert auf einer Polypeptidkette bestehend aus AA. Der einzige Unterschied besteht darin, wie diese Sequenz im Raum gebildet wird und mit deren Hilfe chemische Bindungen eine solche Konformation aufrechterhalten.
Primäre Proteinstruktur
Jedes Protein wird auf Ribosomen gebildet -Nichtmembranzellorganellen, die an der Synthese der Polypeptidkette beteiligt sind. Hier sind Aminosäuren über eine starke Peptidbindung miteinander verbunden und bilden eine Primärstruktur. Eine solche Primärstruktur eines Proteins unterscheidet sich jedoch stark von einer quaternären, weshalb eine weitere Reifung des Moleküls erforderlich ist.
Proteine wie Elastin, Histone, Glutathion sind bereits vorhandenMit einer so einfachen Struktur können sie ihre Funktionen im Körper erfüllen. Für die überwiegende Mehrheit der Proteine ist die nächste Stufe die Bildung einer komplexeren sekundären Konformation.

Sekundäre Proteinstruktur
Die Bildung von Peptidbindungen ist die erste StufeReifung der meisten Proteine. Damit sie ihre Funktionen erfüllen können, muss sich ihre lokale Konformation ändern. Dies wird mit Hilfe von Wasserstoffbrücken erreicht - zerbrechlich, aber gleichzeitig zahlreiche Verbindungen zwischen den basischen und sauren Zentren von Aminosäuremolekülen.
Auf diese Weise wird die Sekundärstruktur des Proteins gebildetQuartär, gekennzeichnet durch einfache Montage und lokale Konformation. Letzteres bedeutet, dass nicht die gesamte Kette transformiert wird. Wasserstoffbrückenbindungen können sich an mehreren Stellen in unterschiedlichen Abständen voneinander bilden, und ihre Form hängt auch von der Art der Aminosäuren und der Art des Zusammenbaus ab.
Lysozym und Pepsin sind Vertreter von Proteinen,mit einer Sekundärstruktur. Pepsin ist an Verdauungsprozessen beteiligt, und Lysozym erfüllt eine Schutzfunktion im Körper und zerstört die Zellwände von Bakterien.

Merkmale der Sekundärstruktur
Lokale Konformationen der Peptidkette könnenvariieren. Einige Dutzend von ihnen wurden bereits untersucht, und drei von ihnen sind die häufigsten. Dazu gehören Alpha-Spirale, Beta-Schichten und Beta-Rotation.
- Die Alpha-Helix ist eine der häufigsten Sekundärstrukturkonformationen in den meisten Proteinen. Es ist ein starrer Stabrahmen mit einem Hub von 0,54 nm. Aminosäurereste sind nach außen gerichtet.
Am häufigsten sind rechtshändige Spiralen,und manchmal können linkshändige Analoga gefunden werden. Die formbildende Funktion wird durch Wasserstoffbrückenbindungen wahrgenommen, die die Locken stabilisieren. Die Kette, die die Alpha-Helix bildet, enthält sehr wenig Prolin und polar geladene Aminosäuren.
- Die Beta-Runde wird in eine separate Konformation isoliert.obwohl es als Teil der Beta-Schicht bezeichnet werden kann. Die Essenz liegt in der Biegung der Peptidkette, die durch Wasserstoffbrückenbindungen unterstützt wird. Normalerweise besteht der Ort der Biegung selbst aus 4-5 Aminosäuren, unter denen das Vorhandensein von Prolin erforderlich ist. Dieser AK ist der einzige mit einem starren und kurzen Skelett, das die Bildung der Kurve selbst ermöglicht.
- Die Beta-Schicht ist eine Kette von Aminosäurendas bildet mehrere Biegungen und stabilisiert sie mit Wasserstoffbrücken. Diese Konformation ist einem in ein Akkordeon gefalteten Blatt Papier sehr ähnlich. Meistens haben aggressive Proteine diese Form, aber es gibt viele Ausnahmen.
Unterscheiden Sie zwischen paralleler und antiparalleler Beta-Schicht. Im ersten Fall fallen die C- und N-Enden an den Biegepunkten und an den Enden der Kette zusammen, im zweiten Fall nicht.
Tertiärstruktur
Eine weitere Verpackung des Proteins führt zur BildungTertiärstruktur. Diese Konformation wird durch Wasserstoff-, Disulfid-, hydrophobe und ionische Bindungen stabilisiert. Durch ihre große Anzahl kann die Sekundärstruktur in eine komplexere Form gedreht und stabilisiert werden.
Trennen Sie globuläre und fibrilläre Proteine. Das Molekül der globulären Peptide ist eine kugelförmige Struktur. Beispiele: Albumin, Globulin, Histone in der Tertiärstruktur.
Fibrilläre Proteine bilden starke Schnüre, Längedas überschreitet ihre Breite. Solche Proteine erfüllen meist strukturelle und formbildende Funktionen. Beispiele sind Fibroin, Keratin, Kollagen, Elastin.

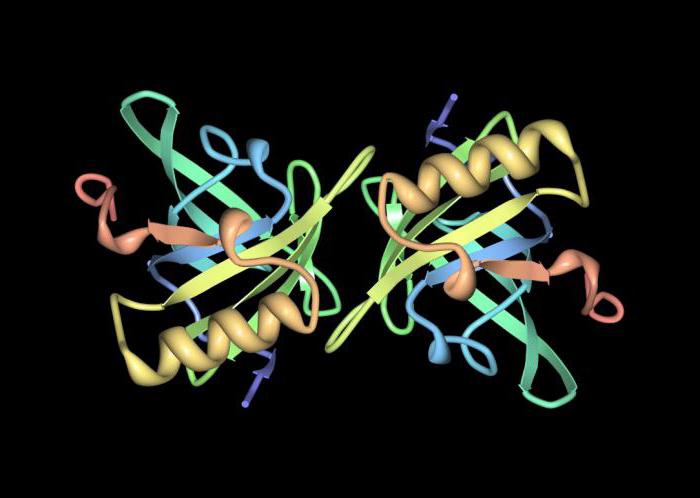
Die Struktur von Proteinen in der Quartärstruktur des Moleküls
Wenn mehrere Kügelchen zu einem zusammengefasst sindkomplex bildet sich die sogenannte quaternäre Struktur. Diese Konformation ist nicht für alle Peptide typisch und wird gebildet, wenn wichtige und spezifische Funktionen ausgeführt werden müssen.
Jedes Globulus in einem komplexen Protein ist eine separate Domäne oder ein separates Protomer. Insgesamt wird die Struktur von Proteinen der quaternären Struktur des Moleküls als Oligomer bezeichnet.
Gewöhnlich hat ein solches Protein mehrere stabileKonformationen, die sich ständig ersetzen, entweder abhängig vom Einfluss externer Faktoren oder wenn unterschiedliche Funktionen ausgeführt werden müssen.
Ein wichtiger Unterschied zwischen der Tertiärstruktur eines Proteins undquaternär sind intermolekulare Bindungen, die für die Verbindung mehrerer Globuli verantwortlich sind. Im Zentrum des gesamten Moleküls befindet sich häufig ein Metallion, das die Bildung intermolekularer Bindungen direkt beeinflusst.
Zusätzliche Proteinstrukturen
Eine Kette von Aminosäuren reicht nicht immer ausdie Funktionen eines Proteins ausführen. In den meisten Fällen sind andere Substanzen organischer und anorganischer Natur an solche Moleküle gebunden. Da dieses Merkmal für die überwältigende Anzahl von Enzymen charakteristisch ist, wird die Zusammensetzung komplexer Proteide normalerweise in drei Teile unterteilt:
- Ein Apoenzym ist ein Proteinteil eines Moleküls, das eine Aminosäuresequenz ist.
- Coenzym ist kein Protein, sondern ein organischer Teil.Es kann verschiedene Arten von Lipiden, Kohlenhydraten oder sogar Nukleinsäuren enthalten. Dies schließt Vertreter von biologisch aktiven Verbindungen ein, zu denen auch Vitamine gehören.
- Ein Cofaktor ist ein anorganischer Teil, der in den allermeisten Fällen durch Metallionen repräsentiert wird.
Die Struktur von Proteinen in einer quaternären StrukturMoleküle erfordern die Beteiligung mehrerer Moleküle unterschiedlicher Herkunft, so dass viele Enzyme drei Komponenten gleichzeitig haben. Ein Beispiel ist Phosphokinase, ein Enzym, das eine Phosphatgruppe von einem ATP-Molekül überträgt.
Wo ist die quaternäre Struktur eines Proteinmoleküls gebildet?
Die Polypeptidkette beginnt bei zu synthetisierenRibosomen der Zelle tritt jedoch eine weitere Reifung des Proteins in anderen Organellen auf. Das neu gebildete Molekül muss in das Transportsystem eintreten, das aus Kernmembran, EPS, Golgi-Apparat und Lysosomen besteht.
Komplikation der räumlichen Struktur des Proteinstritt im endoplasmatischen Retikulum auf, wo nicht nur verschiedene Arten von Bindungen gebildet werden (Wasserstoff, Disulfid, hydrophob, intermolekular, ionisch), sondern auch ein Coenzym und ein Cofaktor gebunden sind. So entsteht die quaternäre Struktur des Proteins.
Wenn das Molekül vollständig einsatzbereit ist, ist estritt entweder in das Zytoplasma der Zelle oder in den Golgi-Apparat ein. Im letzteren Fall werden diese Peptide in Lysosomen gepackt und in andere Zellkompartimente transportiert.
Beispiele für oligomere Proteine
Quartärstruktur ist die Struktur von Proteinen,Dies soll die Erfüllung lebenswichtiger Funktionen in einem lebenden Organismus erleichtern. Die komplexe Konformation organischer Moleküle ermöglicht es zunächst, die Arbeit vieler Stoffwechselprozesse (Enzyme) zu beeinflussen.
Biologisch wichtige Proteine sind Hämoglobin, Chlorophyll und Hämocyanin. Der Porphyrinring ist die Basis dieser Moleküle, in deren Zentrum sich ein Metallion befindet.
Hämoglobin
Quartärstruktur des Hämoglobin-Proteinmolekülsstellt 4 Kügelchen dar, die durch intermolekulare Bindungen verbunden sind. Im Zentrum - Porphin mit Eisenionen. Das Protein wird im Zytoplasma von Erythrozyten transportiert, wo sie etwa 80% des Gesamtvolumens des Zytoplasmas einnehmen.
Die Basis des Moleküls ist Häm, das anorganischer ist und rot gefärbt ist. Es ist auch das primäre Abbauprodukt von Hämoglobin in der Leber.
Wir alle wissen, dass Hämoglobin eine wichtige Rolle spieltTransportfunktion - die Übertragung von Sauerstoff und Kohlendioxid durch den menschlichen Körper. Die komplexe Konformation des Proteinmoleküls bildet spezielle aktive Zentren, die die entsprechenden Gase mit Hämoglobin binden können.
Wenn ein Protein-Gas-Komplex gebildet wird,Es entstehen sogenanntes Oxyhämoglobin und Carbohämoglobin. Es gibt jedoch eine andere Art solcher Assoziationen, die ziemlich stabil ist: Carboxyhämoglobin. Es ist ein Komplex aus Protein und Kohlenmonoxid, dessen Stabilität die Erstickungsattacken mit übermäßiger Toxizität erklärt.

Chlorophyll
Ein weiterer Vertreter von Proteinen mit quaternärer Struktur, deren Domänen bereits vom Magnesiumion unterstützt werden. Die Hauptfunktion des gesamten Moleküls besteht darin, an den Prozessen der Photosynthese in Pflanzen teilzunehmen.
Es gibt verschiedene Arten von Chlorophyllen, dieunterscheiden sich voneinander durch die Radikale des Porphyrinrings. Jede dieser Sorten ist mit einem separaten Buchstaben des lateinischen Alphabets gekennzeichnet. Beispielsweise sind Landpflanzen durch das Vorhandensein von Chlorophyll a oder Chlorophyll b gekennzeichnet, während andere Arten dieses Proteins in Algen vorkommen.

Hämocyanin
Dieses Molekül ist in vielen niederen ein Analogon von HämoglobinTiere (Arthropoden, Weichtiere usw.). Der Hauptunterschied in der Struktur eines Proteins mit einer quaternären Molekülstruktur ist das Vorhandensein eines Zinkions anstelle eines Eisenions. Hämocyanin hat eine bläuliche Farbe.
Manchmal fragen sich die Leute, was es wärewenn Sie menschliches Hämoglobin durch Hämocyanin ersetzen. In diesem Fall wird der übliche Gehalt an Substanzen im Blut, insbesondere Aminosäuren, gestört. Hämocyanin bildet auch instabil einen Komplex mit Kohlendioxid, so dass "blaues Blut" dazu neigen würde, Blutgerinnsel zu bilden.