Най-простите органични съединения са наситени и ненаситени въглеводороди. Те включват вещества от класа алкани, алкини, алкени.
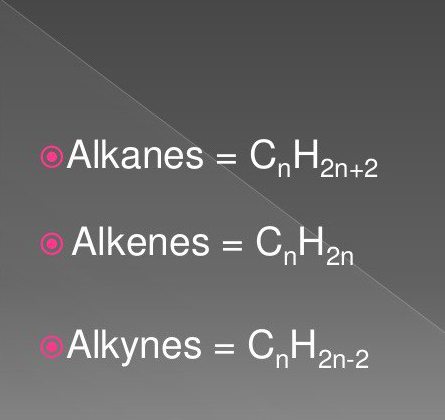
Техните формули включват водородни и въглеродни атоми в определена последователност и количество. Те са често срещани в природата.
Определяне на алкени
Другото им име са олефини или етиленови въглеводороди. Така се нарича този клас съединения през 18 век, когато е открита маслената течност - етиленхлорид.
Алкените включват вещества, състоящи се отводородни и въглеродни елементи. Те се класифицират като ациклични въглеводороди. Тяхната молекула съдържа единична двойна (ненаситена) връзка, свързваща два въглеродни атома един с друг.
Формули на Алкенес
Всеки клас съединения има свое химическо обозначение. В тях символите на елементите на периодичната система показват състава и структурата на връзката на всяко вещество.

Общата формула за алкени е посочена, както следва: CпX2н, където числото n е по-голямо или равно на 2. При дешифрирането му се вижда, че има два водородни атома за всеки въглероден атом.
Молекулните формули на хомоложни алкени са представени от следните структури: C2X4, ° С3X6, C4X8, ° С5X10, ° С6X12, ° С7X14, ° С8X16, ° С9X18, ° С10X20... Вижда се, че всеки следващ въглеводород съдържа още един въглерод и още 2 водорода.
Има графично обозначение на местоположението и реда на химичните съединения между атомите в молекулата, което показва структурната формула на алкените. С помощта на валентни тирета се посочва връзката на въглеродите с водородите.
Структурната формула на алкените може да бъде изобразенав разширена форма, когато са показани всички химични елементи и връзки. По-краткият израз за олефините не показва съединението на въглерод и водород, използвайки валентни тирета.
Скелетната формула обозначава най-простата структура. Прекъснатата линия представлява основата на молекулата, в която въглеродните атоми са представени от нейните върхове и краища, а връзките показват водород.
Как се образуват олефинови имена
Въз основа на систематичната номенклатура, формулатаалкените и техните имена са съставени от структурата на алкани, свързани с наситени въглеводороди. За целта в името на последната суфиксът -an се заменя с -ilen или -en. Пример е образуването на бутилен от бутан и пентен от пентан.
За да посочите позицията на двойна връзка спрямо въглеродните атоми, посочете арабска цифра в края на името.
Името на алкените се основава на обозначениетовъглеводородът с най-дълга верига, съдържащ двойна връзка. За началото на номерирането на веригата обикновено се избира краят, който е най-близо до ненаситеното съединение на въглеродните атоми.
Ако структурната формула на алкените имаклонове, след това посочват имената на радикалите и техния брой и пред тях поставят числа, съответстващи на мястото във въглеродната верига. Следва името на самия въглеводород. Числата обикновено са последвани от тире.
Има ненаситени радикални клонове. Техните имена могат да бъдат тривиални или да се формират според правилата на систематичната номенклатура.
Например, HNC = CH- се означава като етенил или винил.
Изомери
Молекулярните формули на алкените не могат да показват изомеризъм. За този клас вещества обаче, с изключение на етиленовата молекула, е присъща пространствена модификация.

Изомерите на етиленовите въглеводороди могат да бъдат въглероден скелет, позиция на ненаситена връзка, междукласова или пространствена.
Общата формула на алкените определя количествотовъглеродни и водородни атоми във веригата, но тя не показва наличието и местоположението на двойната връзка. Пример е циклопропанът като междукласов изомер на С3X6 (пропилен). Други видове изомерия се появяват в C4X8 или бутен.
Различна позиция на ненаситена връзка се наблюдава вбутен-1 или бутен-2, в първия случай двойното съединение се намира близо до първия въглероден атом, а във втория - в средата на веригата. Изомерията на въглеродния скелет може да се обмисли, като се използва метилпропен (CH3-C (CH3) = СН2) и изобутилен ((CH3) 2C = CH2).
Пространствената модификация е присъща на бутен-2 втранс и цис позиция. В първия случай страничните радикали са разположени над и под основната въглеродна верига с двойна връзка, във втория изомер заместителите са от едната страна.
Характеризиране на олефини
Общата формула на алкените определя физическото състояние на всички представители от този клас. Започвайки с етилен и завършвайки с бутилен (от C2 до С4), веществата съществуват в газообразна форма. Така че безцветният етен има сладникава миризма, ниска разтворимост във вода и молекулното му тегло е по-малко от въздуха.
В течна форма, въглеводороди с хомоложен интервал от С5 до С17... Започвайки с алкен, който има 18 въглеродни атома в основната верига, настъпва преход на физическото състояние в твърда форма.
Всички олефини се считат за слабо разтворими вводна среда, но добър в органични разтворители, като бензен или бензин. Тяхното молекулно тегло е по-малко от това на водата. Увеличаването на въглеродната верига води до увеличаване на температурните показатели по време на топенето и кипенето на тези съединения.
Олефинови свойства
Структурната формула на алкените показва присъствието вскелетът на двойна връзка на π- и σ- съединения от два въглеродни атома. Тази структура на молекулата определя нейните химични свойства. Π-връзката се счита за не много силна, което прави възможно нейното унищожаване с образуването на две нови σ-връзки, които се получават в резултат на свързването на двойка атоми. Ненаситените въглеводороди са електронни донори. Те участват в електрофилни процеси на привързване.
Важно химично свойство на всички алкени епроцес на халогениране с освобождаване на съединения като дихалогенирани вещества. Халогенните атоми са способни да се свързват двойно с въглеродните атоми. Пример е бромирането на пропилен до образуване на 1,2-дибромопропан:
X2С = СН - СН3 + Br2 → BrCH2–CHBr - CH3.
Този процес на неутрализиране на цвета в бромова вода с алкени се счита за качествено доказателство за наличието на двойна връзка.
Важните реакции включват хидрогенирането на олифинис добавяне на молекула на водорода под действието на каталитични метали като платина, паладий или никел. Резултатът е въглеводороди с наситена връзка. Формули на алкани, алкени са дадени по-долу при хидрирането на бутен:
B3–CH2–CH = CH2 + Н2 Нито едно→ CH3–CH2–CH2–CH3.
Процесът на свързване на молекула на водороден халогенид към олефините се нарича
хидрохалогениране, протичащо съгласно правилото,открит от Марковников. Пример за това е хидробромирането на пропилена до образуването на 2-бромопропан. В него водородът се комбинира с двойна връзка с въглерод, който се счита за най-хидрогениран:
B3–CH = CH2 + HBr → CH3–BrCH - CH3.
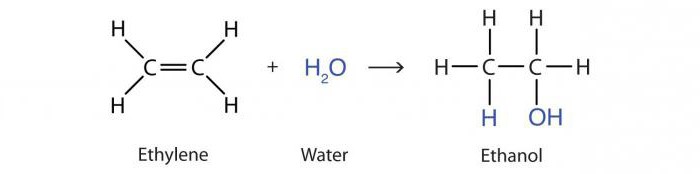
Реакцията на добавяне на вода от алкени под действието на киселини се нарича хидратация. Резултатът е пропанол-2 алкохолна молекула:
B3–HC = CH2 + Н2O → CH3–ОХЧ - СН3.
Когато алкените са изложени на сярна киселина, процесът на сулфонация настъпва:
B3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2-ОХ.
Реакцията протича с образуването на киселинни естери, например изопропил сярна киселина.
Алкените са податливи на окисляване по време на изгарянето им под действието на кислород, за да образуват вода и газ от въглероден диоксид:
2CH3–HC = CH2 + 9O2 → 6CO2 + 6Н2ОТНОСНО.
Взаимодействието на олефиновите съединения иразреденият калиев перманганат под формата на разтвор води до образуването на гликоли или двуатомни алкохоли. Тази реакция също е окислителна с образуването на етилен гликол и обезцветяването на разтвора:
3Н2С = СН2 + 4Н2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Молекулите на алкените могат да участват в полимеризацията със свободен радикал или катионно-анионен механизъм. В първия случай под въздействието на пероксиди се получава полимер от полиетиленов тип.
Според втория механизъм киселините действат като катионни катализатори, а органометалните вещества са анионни с отделянето на стереоселективен полимер.
Какво представляват алканите
Те се наричат още парафини или ограничаващиациклични въглеводороди. Те имат линейна или разклонена структура, която съдържа само наситени прости връзки. Всички представители на хомоложните редици от този клас имат общата формула СпX2n + 2.
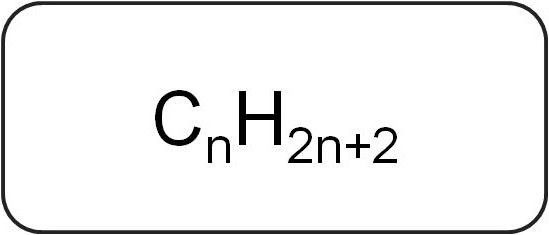
Те съдържат само въглеродни и водородни атоми. Общата формула за алкени е получена от обозначението на наситените въглеводороди.
Имената на алканите и техните характеристики
Най-простият представител на този класе метан. Следват вещества като етан, пропан и бутан. Името им се основава на корена на число на гръцки, към което се добавя суфикс -an. Имената на алкани са изброени в номенклатурата на IUPAC.
Общата формула за алкени, алкини, алкани включвасамо два вида атоми. Те включват елементите въглерод и водород. Броят на въглеродните атоми и в трите класа е еднакъв, разликата се наблюдава само в броя на водорода, който може да бъде отделен или прикрепен. Ненаситените съединения се получават от наситени въглеводороди. Представителите на парафините в молекулата съдържат 2 водородни атома повече от олефините, което се потвърждава от общата формула на алкани, алкени. Структурата на алкените се счита за ненаситена поради наличието на двойна връзка.
Ако свържем броя на водородните и въглеродните атоми в алканите, тогава стойността ще бъде максимална в сравнение с други класове въглеводороди.
Започвайки с метан и завършвайки с бутан (от C1 до С4), веществата съществуват в газообразна форма.
В течна форма, въглеводороди с хомоложен интервал от С5 до С16... Започвайки с алкан, който има 17 въглеродни атома в основната верига, настъпва преход на физическото състояние в твърда форма.
Те се характеризират с изомеризъм във въглеродния скелет и оптични модификации на молекулата.
При парафините се разглеждат въглеродните валентностинапълно заета от съседни въглероди или водороди с образуването на σ-тип връзка. От химическа гледна точка това причинява техните слаби свойства, поради което алканите се наричат наситени или наситени въглеводороди, лишени от афинитет.
Те влизат в реакции на заместване, свързани с радикално халогениране, сулфохлориране или нитриране на молекулата.
Парафините се подлагат на окисляване, горене или разлагане при високи температури. Под действието на ускорителите на реакцията водородните атоми се елиминират или алканите се дехидрогенират.
Какво представляват алкините
Те се наричат още ацетиленови въглеводороди, които имат тройна връзка във въглеродната верига. Структурата на алкините се описва с общата формула СпX2n - 2... От него се вижда, че за разлика от алканите, ацетиленовите въглеводороди нямат четири водородни атома. Те са заменени от тройна връзка, образувана от две π-съединения.
Тази структура определя химичните свойства на този клас. Структурната формула на алкени и алкини ясно показва ненаситеността на техните молекули, както и наличието на двойна (Н2C꞊CH2) и тройни (HC≡CH) връзки.
Името на алкините и техните характеристики
Най-простият представител е ацетиленътили HC≡CH. Нарича се още етин. Произхожда от името на наситен въглеводород, в който се премахва суфиксът -an и се добавя -in. В имената на дългите алкини числото показва местоположението на тройната връзка.
Познавайки структурата на наситени иненаситени, възможно е да се определи под коя буква е посочена общата формула на алкините: а) CnH2n; в) CnH2n + 2; в) CnH2n-2; г) CnH2n-6. Третият вариант е верният отговор.
Започвайки с ацетилен и завършвайки с бутан (от C2 до С4), веществата са от газообразно естество.

В течна форма има въглеводороди с хомоложен интервал от С5 до С17... Започвайки с алкин, който има 18 въглеродни атома в основната верига, преходът на физическото състояние настъпва в твърда форма.
Те се характеризират с изомеризъм във въглеродния скелет, в положението на тройната връзка, както и междукласови модификации на молекулата.
По отношение на химичните характеристики ацетиленовите въглеводороди са подобни на алкените.
Ако алкините имат крайна тройна връзка, тогава тедействат като киселина, за да образуват алкинидни соли, например NaC≡CNa. Наличието на две π-връзки прави молекулата на натриевия ацетиледин силен нуклеофил, който влиза в реакции на заместване.
Ацетиленът се подлага на хлориране в присъствието на меден хлорид за получаване на дихлорацетилен, кондензация под действието на халоалкини с освобождаване на диацетиленови молекули.
Алкините участват в реакциите на добавянеелектрофилен, чийто принцип е в основата на халогенирането, хидрохалогенирането, хидратацията и карбонилирането. Такива процеси обаче са по-слаби от тези на алкените с двойна връзка.
За ацетиленовите въглеводороди са възможни нуклеофилни реакции на присъединяване на молекули алкохол, първичен амин или сероводород.








