الأكثر قيمة بالنسبة للبشرية جمع خصائص مثل الأوزون. العنصر الكيميائي الذي يتكون منه هو الأكسجين O. في الواقع ، الأوزون O3 - واحد من التعديلات الأيروتروبي للأكسجين ،تتكون من ثلاث وحدات صيغة (О ÷ О ÷ О). المركب الأول والأكثر شهرة هو الأكسجين نفسه ، وبصورة أدق الغاز ، الذي يتكون من ذرتيه (O = O) - O2.

التلوُّن هو قدرة مادة كيميائية واحدةعنصر لتشكيل عدد من المركبات البسيطة المختلفة على أساس الخصائص. وبفضل ذلك ، درست البشرية وتستخدم مواد مثل الماس والجرافيت والكبريت أحادي المحور والأكسجين والأكسجين والأوزون. لا يقتصر العنصر الكيميائي الذي له مثل هذه القدرة بالضرورة على تعديلين فقط ، فالبعض الآخر لديه الكثير.
سجل الاتصال
الوحدة المكونة للعديد من العضوية والمواد المعدنية ، بما في ذلك الأوزون - وهو عنصر كيميائي ، والذي تم تعيينه O-oxigen ، في الترجمة من "oxys" اليونانية - الحامض ، و "gignomai" - للولادة.

لأول مرة تعديل مؤثر جديد للأكسجينخلال التجارب مع شحنات كهربائية اكتشف عام 1785 والهولندي مارتن فان مارون، استرعي انتباهه رائحة. وبعد قرن وأشار الفرنسي كريستيان فريدريتش شونبين وجود نفسها بعد عاصفة، حيث كان اسمه الغاز "الرائحة". ولكن بعض العلماء خداع، معتبرا أن حاسة الشم المعطرة نفسه الأوزون. رائحة، التي شعرت ينتمي الى المركبات العضوية، والأكسدة عن طريق تفاعل مع O3لأن الغاز شديد التفاعل.
هيكل الكتروني
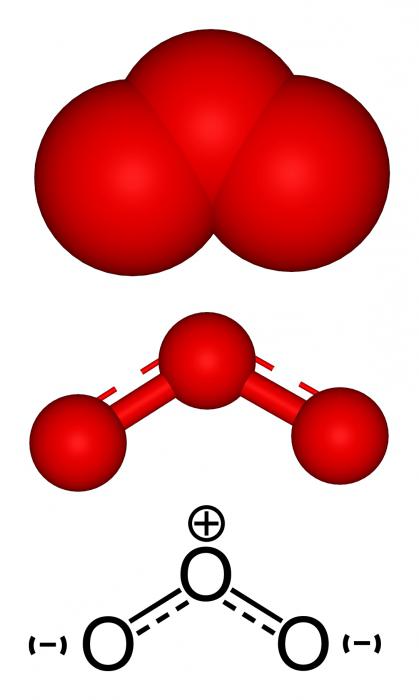
يحتوي الجزء البنيوي نفسه على O2 و O3- عنصر كيميائي. الأوزون لديه بنية أكثر تعقيدا. في الأكسجين ، كل شيء بسيط - يتم توصيل ذرتين من الأكسجين بواسطة رابطة مزدوجة تتكون من المكونين ϭ و π ، وفقا لتكافؤ العنصر. يا3 لديه العديد من الهياكل الرنانة.
طرق التجميع
لتشكيل غاز مثل الأوزون، يجب أن يكون الأكسجين عنصر كيميائي في وسط الغازي في شكل ذرات مفردة. يتم إنشاء مثل هذه الظروف من خلال تصادم جزيئات الأوكسجين O2 مع الإلكترونات خلال شحنات كهربائية أو غيرها من الجسيمات ذات الطاقة العالية، وعندما يتم المشع مع الأشعة فوق البنفسجية.
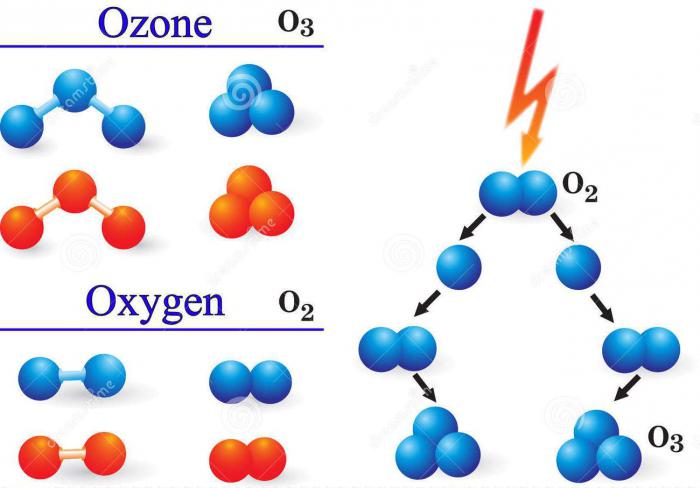
حصة الأسد من مجموع الأوزون فييتم تشكيل الظروف الطبيعية للغلاف الجوي عن طريق الطريقة الكيميائية الضوئية. يفضل الشخص استخدام طرق أخرى في النشاط الكيميائي ، مثل ، على سبيل المثال ، التوليف الكهرولي. وهو يتألف من وضع أقطاب كهربائية من البلاتين في وسط مائي من الإلكتروليت وتبدأ تيارًا. مخطط التفاعل:
H2يا + يا2 → حول3 + ح2 + ه-
الخصائص الفيزيائية
الأكسجين (O) هو وحدة تأسيسية من مادة مثل الأوزون ، وهو عنصر كيميائي له الصيغة ، بالإضافة إلى الكتلة المولية النسبية ، موضحة في جدول Mendeleyev. تشكيل O3، يكتسب oxigen الخصائص التي تختلف اختلافًا جوهريًا عن خصائص O2.

غاز اللون الأزرق - هذه هي الحالة المعتادة لمثل هذامركب ، مثل الأوزون. تم تحديد العنصر الكيميائي ، الصيغة ، الخصائص الكمية - كل هذا في تحديد ودراسة هذه المادة. نقطة الغليان لها هي -111.9 درجة مئوية ، والحالة المسالة لها لون بنفسجي داكن ، بينما تنخفض إلى درجة -197.2 درجة مئوية ، يبدأ الذوبان. في حالة التجميع الصلب ، يكتسب الأوزون لونًا أسود مع لون أرجواني. قابليته للذوبان هي عشرة أضعاف خاصية الأكسجين O2. في معظم التركيزات غير الملحوظة في الهواء ، تشعر برائحة الأوزون ، فهي حادة ومحددة وتشبه رائحة المعدن.
الخصائص الكيميائية
نشطة للغاية ، من وجهة نظر رجعية ،هو غاز الأوزون. العنصر الكيميائي الذي يشكله هو الأكسجين. الخصائص التي تحدد سلوك الأوزون في التفاعل مع المواد الأخرى هي القدرة المؤكسدة العالية وعدم الاستقرار في الغاز نفسه. عند درجات حرارة مرتفعة فإنه يتحلل بمعدل لم يسبق له مثيل ، وتسارع العملية المحفزات مثل أكاسيد المعادن ، والكلور ، وثاني أكسيد النيتروجين وغيرها. إن خصائص المؤكسد متأصلة في الأوزون بسبب خصوصيات بنية الجزيء وحركية واحدة من ذرات الأكسجين ، التي تنقسم الغاز إلى أكسجين:3 → حول2 + O
الأكسجين (وهو لبنة يتم بناء الجزيئات منهامواد مثل الأكسجين والأوزون) هو عنصر كيميائي. كما هو مكتوب في معادلات التفاعل - O ·. الأوزون يؤكسد جميع المعادن ، باستثناء الذهب والبلاتين ومجموعتها الفرعية. يتفاعل مع الغازات في الغلاف الجوي - أكاسيد الكبريت والنيتروجين وغيرها. لا تبقى المواد العضوية خاملة ، خاصة الاختلال السريع للروابط المتعددة من خلال تكوين المركبات الوسيطة. من المهم للغاية أن تكون منتجات التفاعل غير ضارة بالبيئة والإنسان. هذه هي المياه ، والأكسجين ، وأكاسيد أعلى من عناصر مختلفة ، أكاسيد الكربون. لا ينطوي التفاعل مع الأوزون على مركبات ثنائية من الكالسيوم والتيتانيوم والسيليكون مع الأكسجين.

تطبيق
المجال الرئيسي حيث يتم استخدام الغاز "الشم"هو التزييف. إن طريقة التعقيم هذه أكثر فعالية وأكثر أمانًا للكائنات الحية من التطهير بالكلور. عندما ينقى الماء بواسطة الأوزون ، لا يوجد أي تكوين لمشتقات الميثان السامة مستبدلة بالهالوجين الخطير.
على نحو متزايد ، هذه طريقة بيئية للتعقيميجد التطبيق في صناعة المواد الغذائية. يتعامل الأوزون مع معدات التبريد والمستودعات الخاصة بالمنتجات ، بمساعدة منه ، ويزيل الروائح.
بالنسبة للطب ، لا يمكن الاستغناء عن خصائص تعقيم الأوزون. انهم تطهير الجروح والحلول الفسيولوجية. عوز الدم الوريدي ، وكذلك الغاز "الشم" علاج عدد من الأمراض المزمنة.
البحث في الطبيعة والمعنى
مادة الأوزون بسيطة هي عنصر من مكونات الغازالستراتوسفير ، وهي منطقة ذات مساحة قريبة من الأرض تقع على مسافة حوالي 20-30 كم من سطح الكوكب. يحدث عزل هذا المركب خلال العمليات المرتبطة بالتصريفات الكهربائية ، أثناء اللحام ، تشغيل آلات زيروكس. ولكن في الستراتوسفير يتكون 99٪ من إجمالي كمية الأوزون في الغلاف الجوي للأرض ويتضمنه.
وجود الغاز فيالفضاء القريب من الأرض. وهي تشكل طبقة الأوزون المزعومة ، والتي تحمي جميع أشكال الحياة من الإشعاع فوق البنفسجي القاتل للشمس. والغريب في الأمر ، ولكن على قدم المساواة مع فوائد ضخمة ، والغاز نفسه يشكل خطرا على الناس. زيادة تركيز الأوزون في الهواء الذي يتنفسه الشخص ضار بالجسم ، بسبب نشاطه الكيميائي الشديد.









