У таблиці Менделєєва такий хімічний елемент,як миш'як, займає позицію на межі метал - неметалл. За своєю активності він знаходиться між воднем і міддю. Неметаллический характер проявляється в тому, що він здатний виявляти ступінь окислення -3 (AsH3 - арсин). З'єднання з позитивною ступенем окислення +3 володіють амфотерними властивостями, а зі ступенем +5 проявляються його кислотні властивості. Що являє собою оксид миш'яку?

Оксиди і гідроксиди
Існують наступні оксиди миш'яку: As2Про3 і As2Про5. Також є відповідні гідроксиди:
- Метамишьяковістая кислота HAsO2.
- Ортомишьяковістая кислота H3AsO3.
- Метамишьяковая кислота HAsO3.
- Ортомишьяковая кислота H3AsO4.
- Піромишьяковая кислота H4Ас2Про7.

Що таке триоксид миш'яку?
Миш'як утворює два оксиду, з яких As2Про3 має назву триоксид.Це речовина, яка часто використовується для лікування, але це не зовсім нешкідливий хімікат. Це неорганічне з'єднання, яке є основним джерелом органоарсеніческіх з'єднань (з'єднань, що містять хімічний зв'язок c вуглецем) і багатьох інших. Багато застосування As2Про3 є спірними через токсичну природи елемента. Торговою назвою цього з'єднання є Trisenox.
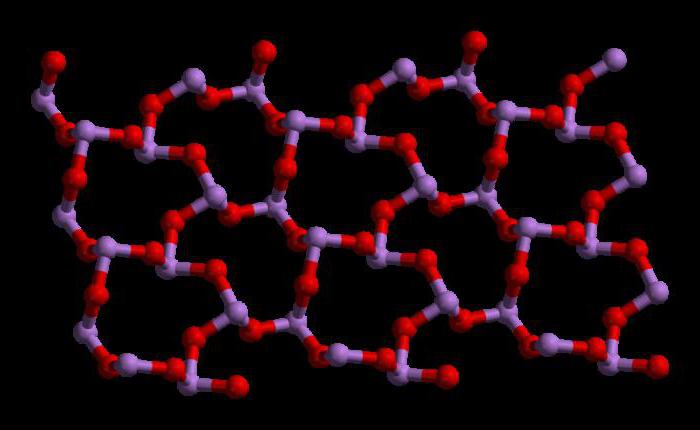
Загальні відомості про триоксидом
Хімічна формула триоксида миш'яку має наступний вигляд As2Про3. Молекулярна маса цього з'єднання становить197,841 г / моль. Існує багато способів отримання цього оксиду. Одним з них них є випал сульфідної руди. Хімічна реакція відбувається наступним чином:
2As2Про3 + 9O2 → 2As2Про3 + 6СО2
Більшість оксидів може бути отримано вяк побічний продукт переробки інших руд. Арсенопірит є спільною домішкою в золоті і міді, і він вивільняє триоксид миш'яку при нагріванні в присутності повітря. Це може привести до серйозного отруєння.

Структура триоксида миш'яку
Триоксид миш'яку має формулу As4Про6 в рідкій і газовій фазах (нижче 800 ° C). У цих фазах він є ізоструктурні з фосфоровим триоксидом (P4Про6). Але при температурі вище 800 ° C As4Про6 руйнується до молекулярного As2Про3. У цій фазі він є ізоструктурні з триоксидом діізотрона (N2Про3). У своєму твердому стані це з'єднання показує полиморфную здатність (здатність існувати в двох або більше формах кристалічної структури).
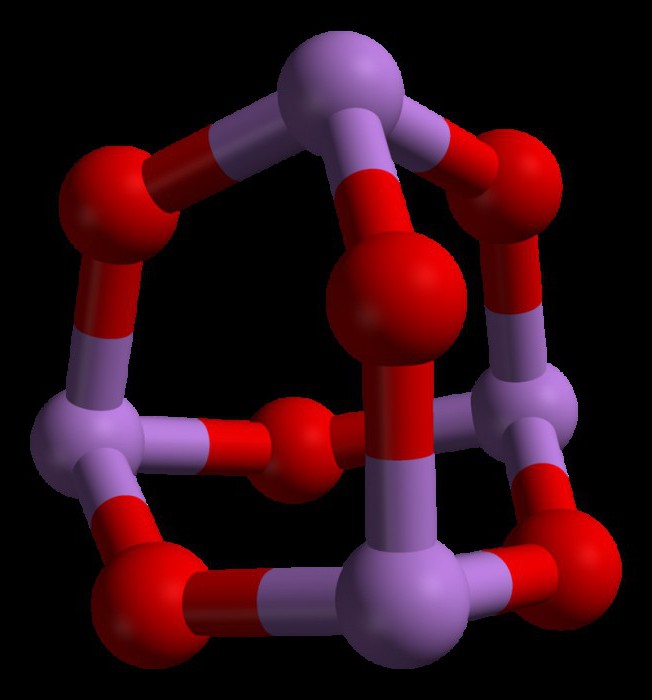
Властивості триоксида миш'яку
Деякі з основних властивостей триоксида миш'яку полягають в наступному:
- Розчини триоксида утворюють слабкі кислоти з водою. Це пов'язано з тим, що з'єднання являє собою амфотерний оксид миш'яку.
- Він розчинний у лужних розчинах і дає арсенати.
- Триоксид миш'яку має високу розчинність в соляній кислоті (HCl) і, нарешті, дає трихлорид миш'яку і концентровану кислоту.
- Він дає пентаоксид (As2Про5) В присутності сильних окислювачів, таких як пероксид водню, озон і азотна кислота.
- Він майже не розчиняється в органічних розчинниках.
- Він виглядає як біле тверде тіло в нормальному фізичному стані.
- Він має температуру плавлення 312,2 ° C і температуру кипіння 465 ° C.
- Щільність цієї речовини становить 4,15 г / см3.
Застосування триоксида миш'яку в медицині
Це хімічна речовина відноситься до класупротипухлинних засобів і застосовується при лікуванні раку. Токсичність миш'яку добре відома. Але триоксид миш'яку є препаратом хіміотерапії і використовується для лікування певних видів раку протягом багатьох років. Рішення, яке використовується для цієї обробки, називається розчином Фаулера. У 1878 році Бостонська міська лікарня повідомила, що цей розчин може бути ефективним в зниженні кількості лейкоцитів у людини.
В результаті As2Про3 був головним чином використаний для лікуваннялейкемії доти, поки його не замінила променева терапія. Але після 1930-х років він поступово відновив свою популярність в лікуванні лейкемії, до тих пір, поки не з'явилася сучасна хіміотерапія. Цей оксид миш'яку вважався найкращим методом лікування хронічної міелогенной лейкемії. Навіть сьогодні ця речовина використовується для лікування конкретного типу гострого промієлоцитарного лейкозу при невдалій ретіноідной або антрациклінової хіміотерапії. Він також використовується для лікування хронічного мієлоїдного лейкозу, множинної мієломи, гострого мієлоїдного лейкозу, лімфоми, раку лімфатичної системи.

Використання триоксида
Триоксид мышьяка широко используется в виробництві безбарвного скла. Це з'єднання також корисно в області електроніки для створення напівпровідників і деяких сплавів. Він використовується і в фарбах. Триоксид миш'яку може виявитися ефективним засобом лікування пухлини головного мозку.
У минулому це речовина використовувалася в стоматології, але оскільки це високотоксична з'єднання, його застосування сучасними стоматологами було припинено. Оксид миш'яку (формула As2Про3) Використовується також як консервант для деревини, але такі матеріали заборонені в багатьох частинах світу. У поєднанні з ацетатом міді трехокись миш'яку дає яскравий пігмент зеленого кольору.
високотоксичну речовину
Сам по собі триоксид має високий рівеньтоксичності. Тому завжди необхідно вжити необхідних заходів обережності, перш ніж його використовувати. Він може бути дуже небезпечним в наступних випадках:
- Приймання їжі. якщо As2Про3 випадково потрапляє в травний тракт, потрібнонегайно зверніться до лікаря. Не рекомендується намагатися викликати блювоту, перш ніж звертатися за медичною допомогою. Потрібно прибрати будь-яку щільну одяг, зняти краватку, розстебнути комір, пояс і т. Д.
- Контакт зі шкірою.У разі зіткнення з будь-якою поверхнею тіла варто негайно промити уражену ділянку великою кількістю води. Заражена одягу і взуття повинні бути негайно вилучені, і їх слід вимити перед повторним використанням. У разі серйозного контакту зі шкірою вам слід негайно звернутися за медичною допомогою. Може бути корисно промивання зараженої області дезинфікуючим милом і застосування антибактеріального крему.
- Попадання в очі. якщо As2Про3 вступає в контакт з очима, перше, що потрібнозробити, це видалити будь-які контактні лінзи і промивати очі великою кількістю води протягом 15 хвилин. Рекомендується використовувати холодну воду. Паралельно з цим хтось повинен викликати швидку.
- Інгаляція.Люди, які вдихали цей газ, повинні бути поміщені в інше місце зі свіжим повітрям. А також потрібно негайно звернутися за медичною допомогою. Якщо важко дихати, слід негайно вводити кисень. Якщо потерпілий не в змозі дихати самостійно, необхідно зробити штучне дихання.
- Це з'єднання може надавати отруйнавплив на людину. У разі потрапляння в організм надмірного його кількості триоксид миш'яку може навіть призвести до смерті. Захисні окуляри і рукавички завжди повинні використовуватися під час роботи з As2Про3. Робота завжди повинна виконуватися в добре провітрюваному приміщенні.

Побічні ефекти
Загальні побічні ефекти цієї речовини включають в себе такі симптоми, як:
- поганий апетит;
- блювота;
- нудота;
- біль в животі;
- запор;
- головний біль;
- втома;
- запаморочення;
- лихоманка;
- проблеми з диханням;
- високий рівень лейкоцитів;
- високий рівень цукру в крові;
- шкірний висип.
Менш поширені побічні ефекти включають в себе:
- сухість в роті;
- плутане дихання;
- біль у грудях;
- низький рівень лейкоцитів;
- м'язову і кісткову біль;
- набрякання обличчя та очей;
- пронос;
- тремор;
- низький рівень цукру в крові;
- низький рівень кисню в крові.
Рідкісні побічні ефекти As2Про3:
- нерегулярне серцебиття (це може навіть призвести до смерті);
- збільшення ваги;
- непритомність;
- неуважність;
- кома;
- розпухлий живіт;
- потемніння шкіри.
Небезпечні для життя симптоми впливу триоксида миш'яку - це збільшення ваги, лихоманка, складність дихання, задишка, грудна біль, кашель.
Триоксид миш'яку є високотоксичнимречовиною, яке може навіть привести до загибелі людини. Тим не менш, він має свою корисність в медичній галузі. Завжди треба вживати заходів обережності.

хімічні реакції
Триоксид мышьяка представляет собой амфотерный вищий оксид миш'яку, і його водні розчини є слабокислотні. Таким чином, він легко розчиняється в лужних розчинах для отримання арсенатів. Він менш розчинний в кислотах, за винятком соляної.
Тільки з сильними окислювачами, такими як озон, перекис водню і азотна кислота, з нього утворюється Пента-оксид миш'яку з +5 ступенем кислотності As2Про5. Що стосується стійкості до окислення, триоксид миш'яку відрізняється від триоксида фосфору, який легко згоряє до пятиокиси фосфору. Редукція дає елементний миш'як або арсин (AsH3).

пентаоксид миш'яку
Хімічною формулою пентаоксиду є As2Про5. Його молярна маса становить 229,8402 г / моль. Це білий гігроскопічний порошок з щільністю 4,32 г / см3. Температура плавлення досягає 315 ° C, приякої він починає розкладатися. Речовина має хорошу розчинність в воді і спирті. Властивості оксиду миш'яку роблять його дуже токсичним і небезпечним для навколишнього середовища. Це неорганічне з'єднання, яке є менш поширеним, високотоксичними і, отже, знаходить лише обмежене комерційне застосування, на відміну від вищого оксиду миш'яку (формула As2Про3).
Миш'як відомий в першу чергу як отрута іканцероген. Його триоксид - це водорозчинний порошок, який виробляє безбарвний, позбавлений смаку і без запаху розчин. Це був популярний спосіб вбивства в середні століття. Його використання триває і сьогодні, але вже в мирних цілях і в невеликій кількості.



