เหตุการณ์ในโลกทางกายภาพนั้นเชื่อมโยงอย่างแยกไม่ออกกับการเปลี่ยนแปลงของอุณหภูมิ ทุกคนรู้จักเธอในวัยเด็กเมื่อเขาตระหนักว่าน้ำแข็งเย็นและน้ำเดือดก็ไหม้ ในเวลาเดียวกัน ความเข้าใจมาว่ากระบวนการของการเปลี่ยนแปลงอุณหภูมิจะไม่เกิดขึ้นทันที ต่อมา ที่โรงเรียน นักเรียนได้เรียนรู้ว่าอะไรเกี่ยวข้องกับการเคลื่อนที่ของความร้อน และกระบวนการที่เกี่ยวข้องกับอุณหภูมิมีการจัดสรรฟิสิกส์ทั้งหมด

อุณหภูมิคืออะไร?
แนวคิดทางวิทยาศาสตร์นี้ถูกนำมาใช้เพื่อแทนที่ความธรรมดาเงื่อนไข คำพูดต่างๆ เช่น ร้อน เย็น หรืออุ่น มักปรากฏขึ้นในชีวิตประจำวัน พวกเขาพูดถึงระดับความร้อนในร่างกาย นี่คือความหมายในทางฟิสิกส์ บวกกับปริมาณสเกลาร์เท่านั้น ท้ายที่สุด อุณหภูมิไม่มีทิศทาง มีเพียงค่าตัวเลขเท่านั้น
ในระบบหน่วยสากล (SI) อุณหภูมิวัดเป็นองศาเซลเซียส (ºС) แต่ในหลายสูตรที่อธิบายปรากฏการณ์ทางความร้อน จำเป็นต้องแปลเป็นเคลวิน (K) สำหรับสิ่งนี้ มีสูตรง่าย ๆ คือ: T = t + 273 ในนั้น T คืออุณหภูมิในเคลวินและ t อยู่ในหน่วยเซลเซียส มาตราส่วนเคลวินสัมพันธ์กับแนวคิดเรื่องอุณหภูมิศูนย์สัมบูรณ์
มีสเกลอุณหภูมิอีกหลายตัวตัวอย่างเช่น ในยุโรปและอเมริกา ใช้ฟาเรนไฮต์ (F) ดังนั้นพวกเขาจะต้องสามารถเขียนเป็นเซลเซียสได้ ในการทำเช่นนี้ จำเป็นต้องลบ 32 ออกจากค่าที่อ่านได้ใน F แล้วหารด้วย 1.8

การทดลองที่บ้าน
ในการอธิบายนี้ จำเป็นต้องรู้แนวคิดเช่น อุณหภูมิ การเคลื่อนที่ของความร้อน และง่ายต่อการทำการทดลองนี้
สำหรับเขาคุณต้องใช้สามตู้คอนเทนเนอร์ควรมีขนาดใหญ่พอที่จะใส่มือได้ง่าย เติมน้ำที่มีอุณหภูมิต่างกัน ในช่วงแรกควรจะเย็นมาก ในวินาที - อุ่นเครื่อง เทน้ำร้อนลงในน้ำที่สามซึ่งคุณสามารถจับมือได้
ตอนนี้ประสบการณ์ของตัวเอง จุ่มมือซ้ายลงในภาชนะที่มีน้ำเย็น และมือขวาด้วยมือที่ร้อนที่สุด รอสองสามนาที นำออกมาแช่ในภาชนะที่มีน้ำอุ่นทันที
ผลลัพธ์จะออกมาอย่างคาดไม่ถึงมือซ้ายจะรู้สึกว่าน้ำอุ่น มือขวาจะรู้สึกถึงน้ำเย็น นี่เป็นเพราะความจริงที่ว่าสมดุลทางความร้อนถูกสร้างขึ้นในขั้นต้นด้วยของเหลวเหล่านั้นซึ่งมือถูกแช่ในตอนแรก แล้วความสมดุลนี้ก็ถูกรบกวนอย่างมาก
หลักการพื้นฐานของทฤษฎีจลนพลศาสตร์ระดับโมเลกุล
มันอธิบายปรากฏการณ์ทางความร้อนทั้งหมด และข้อความเหล่านี้ค่อนข้างง่าย ดังนั้น ในการสนทนาเกี่ยวกับการเคลื่อนที่ด้วยความร้อน บทบัญญัติเหล่านี้จำเป็นต้องทราบ
อันดับแรก:สารเกิดขึ้นจากอนุภาคที่เล็กที่สุดซึ่งอยู่ห่างจากกัน นอกจากนี้ อนุภาคเหล่านี้สามารถเป็นได้ทั้งโมเลกุลและอะตอม และระยะห่างระหว่างกันนั้นมากกว่าขนาดอนุภาคหลายเท่า
ประการที่สอง: ในสารทั้งหมดจะมีการเคลื่อนที่ด้วยความร้อนของโมเลกุลซึ่งไม่เคยหยุดนิ่ง ในกรณีนี้ อนุภาคจะเคลื่อนที่แบบสุ่ม (อย่างโกลาหล)
ประการที่สาม: อนุภาคมีปฏิสัมพันธ์ซึ่งกันและกัน การกระทำนี้เกิดจากแรงดึงดูดและแรงผลัก ค่าของมันขึ้นอยู่กับระยะห่างระหว่างอนุภาค
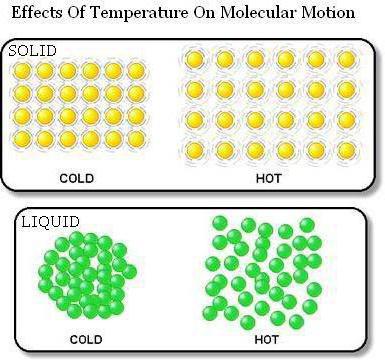
การยืนยันบทบัญญัติแรกของ ICB
หลักฐานว่าร่างกายประกอบด้วยอนุภาคระหว่างที่มีช่องว่างการขยายตัวทางความร้อนจะทำหน้าที่ ดังนั้นเมื่อร่างกายได้รับความร้อน ขนาดของมันก็จะเพิ่มขึ้น สิ่งนี้เกิดขึ้นเนื่องจากการกำจัดอนุภาคออกจากกัน
การยืนยันข้างต้นก็คือการแพร่กระจาย นั่นคือการแทรกซึมของโมเลกุลของสารหนึ่งระหว่างอนุภาคของอีกสารหนึ่ง ยิ่งกว่านั้นการเคลื่อนไหวนี้กลับกลายเป็นว่าร่วมกัน การแพร่กระจายจะเกิดขึ้นเร็วกว่าโมเลกุลที่อยู่ไกลออกไป ดังนั้นในก๊าซ การแทรกซึมซึ่งกันและกันจะเกิดขึ้นเร็วกว่าในของเหลวมาก และในของแข็ง การแพร่จะใช้เวลาหลายปี
นอกจากนี้ กระบวนการหลังยังอธิบายการเคลื่อนที่ของความร้อนด้วย ท้ายที่สุดการแทรกซึมของสารซึ่งกันและกันเกิดขึ้นโดยไม่มีการรบกวนจากภายนอก แต่สามารถเร่งได้โดยการให้ความร้อนแก่ร่างกาย
การยืนยันบทบัญญัติที่สองของ ICB
หลักฐานชัดเจนว่ามีการเคลื่อนที่เชิงความร้อนคือการเคลื่อนที่แบบบราวเนียนของอนุภาค ถือเป็นอนุภาคแขวนลอยนั่นคือสำหรับอนุภาคที่มีขนาดใหญ่กว่าโมเลกุลของสารอย่างมีนัยสำคัญ อนุภาคเหล่านี้อาจเป็นจุดของฝุ่นหรือเมล็ดพืช และควรวางในน้ำหรือแก๊ส
สาเหตุของการเคลื่อนไหวผิดปกติของน้ำหนักอนุภาคในความจริงที่ว่าโมเลกุลทำหน้าที่จากทุกด้าน การกระทำของพวกเขาไม่แน่นอน ขนาดของผลกระทบในแต่ละช่วงเวลานั้นแตกต่างกัน ดังนั้นแรงที่เกิดขึ้นจึงถูกชี้นำไม่ทางใดก็ทางหนึ่ง
หากเราพูดถึงอัตราการเคลื่อนที่ด้วยความร้อนของโมเลกุล แสดงว่ามีชื่อเฉพาะคือ รูต-ค่าเฉลี่ย-กำลังสอง สามารถคำนวณได้โดยใช้สูตร:
v = √ [(3kT) / m0].
ในนั้น T คืออุณหภูมิในเคลวิน m0 คือมวลของหนึ่งโมเลกุล k คือค่าคงที่ Boltzmann (k = 1.38 * 10-23 เจ / เค).

การยืนยันบทบัญญัติที่สามของ ICB
อนุภาคดึงดูดและขับไล่ ในการอธิบายกระบวนการต่างๆ ที่เกี่ยวข้องกับการเคลื่อนที่ด้วยความร้อน ความรู้นี้มีความสำคัญ
ท้ายที่สุดแล้ว แรงของปฏิสัมพันธ์ขึ้นอยู่กับมวลรวมสถานะของสสาร ดังนั้นก๊าซจึงไม่มีอยู่จริงเนื่องจากอนุภาคถูกกำจัดออกไปมากจนไม่ปรากฏผลกระทบ ในของเหลวและของแข็ง สิ่งเหล่านี้สามารถรับรู้ได้และช่วยให้คงปริมาณของสารไว้ได้ ในตอนหลังพวกเขายังรับประกันการรักษารูปร่าง
หลักฐานการมีอยู่ของแรงดึงดูดและแรงผลักคือการปรากฏตัวของแรงยืดหยุ่นในระหว่างการเสียรูปของร่างกาย ดังนั้นด้วยการยืดตัว แรงดึงดูดระหว่างโมเลกุลจะเพิ่มขึ้น และด้วยแรงอัด แรงผลัก แต่ในทั้งสองกรณี ร่างกายจะกลับคืนสู่สภาพเดิม

พลังงานเฉลี่ยของการเคลื่อนที่ด้วยความร้อน
สามารถเขียนได้จากสมการพื้นฐานของ MKT:
(pV) / N = (2E) / 3
ในสูตรนี้ p คือความดัน V คือปริมาตร N คือจำนวนโมเลกุล และ E คือพลังงานจลน์เฉลี่ย
ในทางกลับกัน สมการนี้สามารถเขียนได้ดังนี้:
(pV) / N = kT
หากคุณรวมเข้าด้วยกัน คุณจะได้ความเท่าเทียมกันดังต่อไปนี้:
(2E) / 3 = kT
จากนั้นทำตามสูตรต่อไปนี้สำหรับพลังงานจลน์เฉลี่ยของโมเลกุล:
อี = (3kT) / 2.
จากนี้จะเห็นได้ว่าพลังงานเป็นสัดส่วนกับอุณหภูมิของสาร นั่นคือเมื่อหลังเพิ่มขึ้นอนุภาคจะเคลื่อนที่เร็วขึ้น นี่คือแก่นแท้ของการเคลื่อนที่ด้วยความร้อนซึ่งมีอยู่ตราบเท่าที่มีอุณหภูมิอื่นที่ไม่ใช่ศูนย์สัมบูรณ์








