กลศาสตร์ควอนตัมส่วนใหญ่ยังคงอยู่เหนือขอบเขตเข้าใจ ดูเหมือนวิเศษมาก เช่นเดียวกับตัวเลขควอนตัมซึ่งปัจจุบันยังคงลึกลับอยู่ บทความนี้อธิบายถึงแนวคิด ประเภท และหลักการทั่วไปในการทำงานกับพวกเขา
ลักษณะทั่วไป

ตัวเลขควอนตัมจำนวนเต็มหรือครึ่งจำนวนเต็มสำหรับกายภาพปริมาณถูกกำหนดโดยค่าที่ไม่ต่อเนื่องทุกประเภทที่กำหนดลักษณะระบบของควอนตัม (โมเลกุล, อะตอม, นิวเคลียส) และอนุภาคมูลฐาน การใช้งานมีความเกี่ยวข้องอย่างใกล้ชิดกับการมีอยู่ของค่าคงที่พลังค์ ความไม่ต่อเนื่องของกระบวนการที่เกิดขึ้นในพิภพเล็กสะท้อนถึงจำนวนควอนตัมและความหมายทางกายภาพของพวกมัน พวกเขาถูกนำมาใช้ครั้งแรกเพื่ออธิบายกฎที่ควบคุมสเปกตรัมของอะตอม แต่ความหมายทางกายภาพและความไม่ต่อเนื่องของปริมาณแต่ละอย่างเปิดเผยในกลศาสตร์ควอนตัมเท่านั้น
ชุดที่กำหนดสถานะที่ละเอียดถี่ถ้วนระบบนี้เรียกว่าสมบูรณ์ ทุกรัฐรับผิดชอบค่าที่เป็นไปได้จากชุดดังกล่าวเป็นระบบสถานะที่สมบูรณ์ ตัวเลขควอนตัมในวิชาเคมีที่มีระดับความอิสระของอิเล็กตรอนเป็นตัวกำหนดพิกัดเชิงพื้นที่สามพิกัดและระดับความอิสระภายใน - การหมุน
โครงสร้างของอิเล็กตรอนในอะตอม
อะตอมประกอบด้วยนิวเคลียสและอิเล็กตรอนระหว่างโดยที่แรงของธรรมชาติไฟฟ้าสถิตกระทำการ พลังงานจะเพิ่มขึ้นเมื่อระยะห่างระหว่างนิวเคลียสกับอิเล็กตรอนลดลง เป็นที่เชื่อกันว่าพลังงานศักย์จะเป็นศูนย์หากมันถูกกำจัดออกจากนิวเคลียสอย่างไม่สิ้นสุด สถานะนี้ใช้เป็นจุดอ้างอิง ดังนั้นพลังงานสัมพัทธ์ของอิเล็กตรอนจึงถูกกำหนด
เปลือกอิเล็กตรอนเป็นชุดของระดับพลังงาน ของหนึ่งในนั้นแสดงโดยเลขควอนตัมหลัก n

หมายเลขหลัก
หมายถึงระดับพลังงานจำเพาะด้วยชุดของออร์บิทัลที่มีค่าใกล้เคียงกัน ซึ่งประกอบด้วยตัวเลขธรรมชาติ: n = 1, 2, 3, 4, 5 ... เมื่ออิเล็กตรอนเคลื่อนที่จากระดับหนึ่งไปอีกระดับหนึ่ง เลขควอนตัมหลักจะเปลี่ยนไป โปรดทราบว่าไม่ใช่ทุกระดับจะเต็มไปด้วยอิเล็กตรอน เมื่อเติมเปลือกของอะตอมจะใช้หลักการของพลังงานน้อยที่สุด สภาพของเขาในกรณีนี้เรียกว่าไม่ตื่นเต้นหรือเป็นพื้นฐาน
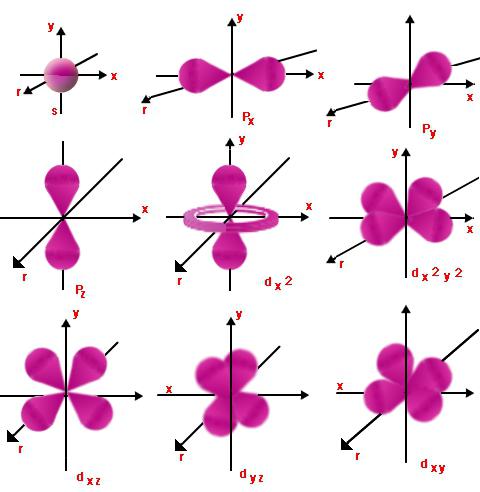
เลขวงโคจร
แต่ละระดับมีออร์บิทัลพวกมันที่มีพลังงานคล้ายคลึงกันก่อตัวเป็นระดับย่อย การมอบหมายดังกล่าวทำโดยใช้การโคจร (หรือที่เรียกว่าด้าน) หมายเลขควอนตัม l ซึ่งรับค่าของจำนวนเต็มจากศูนย์ถึง n - 1 ดังนั้นอิเล็กตรอนที่มีตัวเลขควอนตัมหลักและวงโคจร n และ l สามารถเท่ากันได้ โดยเริ่มต้น l = 0 และลงท้ายด้วย l = n - 1
นี้แสดงให้เห็นธรรมชาติของการเคลื่อนไหวของตามลำดับระดับย่อยและระดับพลังงาน สำหรับ l = 0 และค่าใดๆ ของ n เมฆอิเล็กตรอนจะมีรูปทรงกลม รัศมีของมันจะเป็นสัดส่วนโดยตรงกับ n ที่ l = 1 เมฆอิเล็กตรอนจะอยู่ในรูปของอนันต์หรือรูปที่แปด ยิ่งค่าของ l มากเท่าไหร่ รูปร่างก็จะยิ่งซับซ้อนมากขึ้นเท่านั้น และพลังงานของอิเล็กตรอนก็จะเพิ่มขึ้น
ตัวเลขแม่เหล็ก
Ml คือเส้นโครงของวงโคจร (ด้าน)โมเมนตัมเชิงมุมไปยังทิศทางใดทิศทางหนึ่งของสนามแม่เหล็ก มันแสดงให้เห็นการวางแนวเชิงพื้นที่ของออร์บิทัลเหล่านั้นซึ่งมีจำนวน l เท่ากัน Ml สามารถมีค่าต่างกัน 2l + 1 จาก -l ถึง + l
เลขควอนตัมแม่เหล็กอีกตัวหนึ่งเรียกว่าสปิน - ms ซึ่งเป็นช่วงเวลาที่เหมาะสมของจำนวนการเคลื่อนไหว เพื่อทำความเข้าใจสิ่งนี้ เราสามารถจินตนาการถึงการหมุนของอิเล็กตรอนรอบแกนของมันเอง นางสาวสามารถเป็น -1/2, +1/2, 1
โดยทั่วไป สำหรับอิเล็กตรอนใดๆ ค่าสัมบูรณ์ของการหมุนคือ s = 1/2 และ ms หมายถึงการฉายภาพไปยังแกน
หลักการของ Pauli: อะตอมไม่สามารถมีอิเล็กตรอนสองตัวที่มีเลขควอนตัมเหมือนกัน 4 ตัว อย่างน้อยหนึ่งในนั้นควรจะยอดเยี่ยม
กฎของการวาดสูตรของอะตอม
- หลักการของพลังงานขั้นต่ำ ระดับและระดับย่อยซึ่งอยู่ใกล้กับแกนกลางจะถูกเติมก่อนตามกฎของ Klechkovsky
- ตำแหน่งขององค์ประกอบระบุว่าอิเล็กตรอนถูกกระจายไปตามระดับพลังงานและระดับย่อย:
- ตัวเลขตรงกับประจุของอะตอมและจำนวนอิเล็กตรอน
- เลขคาบสอดคล้องกับจำนวนระดับพลังงาน
- หมายเลขกลุ่มตรงกับจำนวนเวเลนซ์อิเล็กตรอนในอะตอม
- กลุ่มย่อยแสดงการกระจายของพวกเขา

อนุภาคมูลฐานและนิวเคลียส
เลขควอนตัมในฟิสิกส์อนุภาคคือลักษณะภายในซึ่งกำหนดปฏิสัมพันธ์และกฎแห่งการเปลี่ยนแปลง นอกเหนือจากการหมุนแล้ว นี่คือประจุไฟฟ้า Q ซึ่งสำหรับอนุภาคมูลฐานทั้งหมดจะเป็นศูนย์หรือเป็นจำนวนเต็ม ลบหรือบวก ประจุแบริออน B (ในอนุภาค - ศูนย์หรือหนึ่ง, ในปฏิปักษ์ - ศูนย์หรือลบหนึ่ง); ประจุ lepton โดยที่ Le และ Lm มีค่าเท่ากับศูนย์หนึ่งและในปฏิปักษ์ - ศูนย์และลบหนึ่ง ไอโซโทปหมุนด้วยจำนวนเต็มหรือครึ่งจำนวนเต็ม; ความแปลกประหลาด S และอื่น ๆ ตัวเลขควอนตัมเหล่านี้ใช้กับทั้งอนุภาคมูลฐานและนิวเคลียสของอะตอม
ในความหมายกว้างๆ เรียกว่า กายภาพปริมาณที่กำหนดการเคลื่อนที่ของอนุภาคหรือระบบและถูกคงไว้ อย่างไรก็ตาม ไม่จำเป็นเลยที่จะต้องอยู่ในสเปกตรัมที่ไม่ต่อเนื่องของค่าที่เป็นไปได้ทั้งหมด









