Binarna jedinjenja su supstance koje formiraju dva različita hemijska elementa. Ovaj termin se koristi za označavanje kvalitativnog i kvantitativnog sastava neorganskih jedinjenja.
Binarna hemijska jedinjenja se smatraju važnimobjekat u proučavanju prirode supstanci. Prilikom njihovog opisivanja koriste se sledeći koncepti: polarizacija veze, oksidaciono stanje, valencija. Ovi hemijski termini omogućavaju da se razume suština formiranja hemijske veze, strukturne karakteristike neorganskih supstanci.
Razmotrimo glavne klase binarnih jedinjenja, karakteristike njihove hemijske strukture i svojstva i neke oblasti njihove industrijske primene.

Oksidi
Ova klasa neorganskih supstanci je najčešća u prirodi. Među poznatim predstavnicima ove grupe jedinjenja izdvajamo:
- silicijum oksid (rečni pesak);
- vodonik oksid (voda);
- угљен диоксид;
- glina (aluminijum oksid);
- gvozdena ruda (oksidi gvožđa).
Takva binarna jedinjenja su složene supstance, koje nužno sadrže kiseonik, koji pokazuje oksidaciono stanje od -2.
Agregatno stanje oksida
Jedinjenja bakra, kalcijuma, gvožđa sukristalne čvrste materije. Oksidi nekih nemetala imaju isto stanje agregacije, na primer, heksavalentni sumpor, petovalentni fosfor, silicijum. Tečnost u normalnim uslovima je voda. Ogromna većina kiseonikovih jedinjenja nemetala su gasovi.
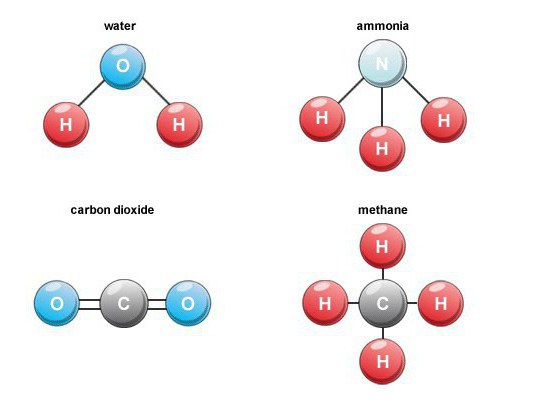
Карактеристике образовања
Nastaju mnoga binarna jedinjenja kiseonikaу природи. Na primer, tokom sagorevanja goriva, disanja, raspadanja organske materije, nastaje ugljen-dioksid (ugljen-monoksid 4). U vazduhu, njegov zapreminski sadržaj je oko 0,03 odsto.
Slična binarna jedinjenja su proizvodiaktivnost vulkana, kao i sastavni deo mineralne vode. Ugljen-dioksid ne podržava sagorevanje, pa se ovo hemijsko jedinjenje koristi za gašenje požara.
Isparljiva jedinjenja vodonika
Takva binarna jedinjenja su važna grupa.supstance koje sadrže vodonik. Među predstavnicima industrijskog značaja zapažamo metan, vodu, vodonik sulfid, amonijak, kao i vodonik halogenide.
Neka od isparljivih vodoničnih jedinjenja su prisutna u zemljišnim vodama i živim organizmima, pa se može govoriti o njihovoj geohemijskoj i biohemijskoj ulozi.
Za sastavljanje binarnih jedinjenja ovog tipa na prvo mesto se stavlja vodonik koji ima valenciju. Drugi element je nemetal sa negativnim oksidacionim stanjem.
Da uredi indekse u binarnom spojunajmanji zajednički višekratnik je određen između valencija. Broj atoma svakog elementa se određuje tako što se podeli valentnošću svakog elementa koji je deo jedinjenja.

Хлороводоник
Razmotrite formule za binarna jedinjenja:hlorovodonik i amonijak. Upravo su ove supstance važne za savremenu hemijsku industriju. HCl u normalnim uslovima je gasovito jedinjenje koje je veoma rastvorljivo u vodi. Nakon rastvaranja gasa hlorovodonika, formira se hlorovodonična kiselina koja se koristi u mnogim hemijskim procesima i industrijskim lancima.
Ovo binarno jedinjenje se nalazi u želudačnom soku ljudi i životinja, predstavlja barijeru za patogene mikrobe koji sa hranom prodiru u stomak.
Među glavnim oblastima primene hlorovodonične kiseline izdvajamo proizvodnju hlorida, sintezu proizvoda koji sadrže hlor, jetkanje metala, čišćenje cevi od oksida i karbonata i proizvodnju kože.
Amonijak koji ima formulu NH3, je bezbojni gas saspecifičan oštar miris. Njegova neograničena rastvorljivost u vodi omogućava dobijanje amonijaka, koji je tražen u medicini. U prirodi, ovo binarno jedinjenje nastaje u procesu raspadanja organskih proizvoda, koji sadrže azot.

Класификација оксида
Binarno jedinjenje metala koje sadrži kiseonik i ima valenciju od 1 ili 2 je osnovni oksid. Na primer, ova grupa uključuje okside alkalnih i zemnoalkalnih metala.
Oksidi nemetala, kao i metali sa valentnošću većom od 4, su kisela jedinjenja.
U zavisnosti od hemijskih svojstava, predstavnici ove klase podeljeni su na grupe koje formiraju i ne formiraju soli.
Među tipičnim predstavnicima druge grupe primećujemo ugljen monoksid (CO), azot oksid 1 (NO).
Formiranje sistematskih naziva jedinjenja
Među zadacima koji se nude maturantima koji položedržavnog ispita iz hemije, postoji i ovo: „Izradite molekularne formule mogućih binarnih kiseonikovih jedinjenja sumpora (azota, fosfora).“ Da biste se nosili sa zadatkom, potrebno je imati ideju ne samo o algoritmu, već io karakteristikama nomenklature ove klase neorganskih supstanci.
Prilikom formiranja imena binarnejedinjenja, u početku označavaju element koji se nalazi desno u formuli, dodajući sufiks "id". Zatim navedite ime prvog elementa. Za kovalentna jedinjenja se dodaju prefiksi, pomoću kojih možete uspostaviti kvantitativni odnos između sastavnih delova binarnog jedinjenja.
Na primer TAKO3 - sumpor trioksid, N2Ох4 - azot tetroksid, I2CL6 - dioda heksahlorid.
Ako je hemijski element prisutan u binarnom jedinjenju koje može da pokaže različita oksidaciona stanja, oksidaciono stanje je naznačeno u zagradi iza naziva jedinjenja.
Na primer, dva jedinjenja gvožđa se razlikuju po imenu: FeCL3 - oksid gvožđa (3), FeCL2 - oksid gvožđa (2).
Za hidride, posebno nemetalne elemente, koriste trivijalna imena. Тако х2O - voda, HCL - hlorovodonik, HI - jodid vodonik, HF - fluorovodonična kiselina.

Kationi
Pozitivni joni onih elemenata kojisposobni da formiraju samo jedan stabilan jon, daju ista imena kao i sami simboli. Ovo uključuje sve predstavnike prve i druge grupe periodnog sistema Mendeljejeva.
Na primer, katjoni natrijuma i magnezijuma imaju oblik: Na+, Mg2+... Prelazni elementi su sposobni da formiraju nekoliko tipova katjona, pa naziv mora ukazivati na valentnost koja se manifestuje u svakom pojedinačnom slučaju.
Anioni
Za jednostavne (monoatomske) i složene (poliatomske) anjone koristi se sufiks –id.
Rasprostranjen oksoanion izvesnogelement je sufiks -am. Za oksoanjon elementa u formuli sa nižim stepenom oksidacije koristi se sufiks –it. Za minimalno stanje oksidacije koristi se prefiks hipo, a za maksimalnu vrednost se koristi prefiks. Na primer, jon O2- je oksidni jon, a O- - peroksid.
Postoje i različiti trivijalni nazivi za hidride. Na primer, N2Кс4 nazvan hidrazin, i PH3 nazvan fosfin.
Oksoanjoni koji sadrže sumpor imaju sledeća imena:
- ЦО42- - sulfat;
- Са2Ох32- - tiosulfat;
- NCS- - tiocijanat.
Со
Mnogi završni testovi iz hemije sugerišusledeći zadatak: „Sastaviti formule binarnih metalnih jedinjenja“. Ako takva jedinjenja sadrže anjone hlora, broma, joda, takva jedinjenja se nazivaju halogenidi i pripadaju klasi soli. Prilikom sastavljanja formula ovih binarnih jedinjenja, na prvo mesto se stavlja metal, zatim odgovarajući halid jon.
Da bi se odredio broj atoma svakog elementa, nalazi se najmanji višekratnik između valencija, a prilikom deljenja dobijaju se indeksi.
Ova jedinjenja imaju visoku tačku topljenjai ključanje, dobra rastvorljivost u vodi, u normalnim uslovima su čvrste materije. Na primer, natrijum i kalijum hloridi se nalaze u morskoj vodi.
Ljudi koriste kuhinjsku so od davnina.Trenutno, upotreba ovog binarnog jedinjenja nije ograničena na potrošnju hrane. Elektroliza vodenog rastvora natrijum hlorida proizvodi metalni natrijum i gasoviti hlor. Ovi proizvodi se koriste u raznim industrijskim procesima, na primer za proizvodnju natrijum hidroksida, hlorovodonika.
Značenje binarnih jedinjenja
Ova grupa uključuje veliki brojsupstance, stoga možemo sa sigurnošću govoriti o obimu njihove upotrebe u različitim sferama ljudske aktivnosti. Amonijak se u hemijskoj industriji koristi kao prekursor u proizvodnji azotne kiseline, u proizvodnji mineralnih đubriva. To je binarno jedinjenje koje se koristi u finoj organskoj sintezi i dugo se koristi u rashladnim uređajima.
Zbog jedinstvene tvrdoće volfram karbida,ovo jedinjenje je našlo primenu u proizvodnji raznih alata za sečenje. Hemijska inertnost ovog binarnog jedinjenja omogućava da se koristi u agresivnim sredinama: laboratorijska oprema, pećnice.
Gas za smeh (azot oksid 1) pomešan sa kiseonikom se koristi u medicini za opštu anesteziju.
Sva binarna jedinjenja imaju kovalentnu ili jonsku hemijsku vezu, molekularnu, jonsku ili atomsku kristalnu rešetku.

Закључак
Prilikom sastavljanja formula za binarna jedinjenjapotrebno je pratiti određeni redosled radnji. Prvo se snima element koji pokazuje pozitivno oksidaciono stanje (ima manju električnu negativnost). Prilikom određivanja vrednosti oksidacionog stanja drugog elementa, broj grupe u kojoj se on nalazi oduzima se od osam. Ako se dobijeni brojevi razlikuju jedan od drugog, određuje se najmanji zajednički višekratnik, zatim se izračunavaju indeksi.
Pored oksida, ova jedinjenja uključujukarbidi, silicidi, peroksidi, hidridi. Aluminijum i kalcijum karbidi se koriste za laboratorijsku proizvodnju metana i acetilena, peroksidi se koriste u hemijskoj industriji kao jaki oksidanti.
Halid kao što je fluorovodonik (fluorovodonikkiselina), koristi se u elektrotehnici za lemljenje. Među najvažnijim binarnim jedinjenjima, bez kojih je teško zamisliti postojanje živih organizama, prednjači voda. Strukturne karakteristike ovog neorganskog jedinjenja se detaljno proučavaju u školskom kursu hemije. Na njenom primeru momci dobijaju ideju o redosledu radnji prilikom sastavljanja formula za binarna jedinjenja.
U zaključku, napominjemo da je teško naći takvu sferu savremene industrije, oblast ljudskog života, gde god se koriste razna binarna jedinjenja.