Најједноставнија органска једињења су засићени и незасићени угљоводоници. Ту спадају супстанце класе алкана, алкини, алкени.
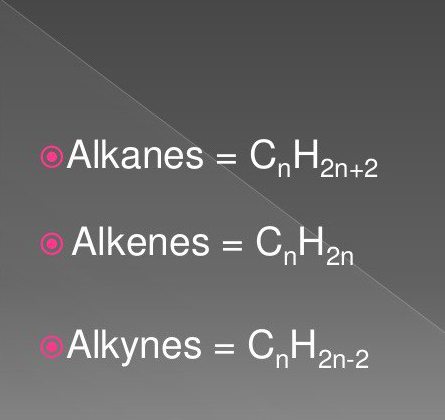
Њихове формуле укључују атоме водоника и угљеника у одређеном низу и количини. Често се налазе у природи.
Одређивање алкена
Њихово друго име су олефини или етилен угљоводоници. Тако се називала ова класа једињења у 18. веку када је откривена уљна течност - етилен хлорид.
Алкени укључују супстанце које се састоје оделементи водоника и угљеника. Класификовани су као ациклични угљоводоници. Њихов молекул садржи једну двоструку (незасићену) везу која повезује два атома угљеника један са другим.
Формуле алкена
Свака класа једињења има своју хемијску ознаку. У њима симболи елемената периодичног система указују на састав и структуру везе сваке супстанце.

Општа формула за алкене означава се на следећи начин: Ц.нКс2н, где је број н већи или једнак 2. При дешифровању се види да за сваки атом угљеника постоје два атома водоника.
Молекуларне формуле алкена из хомологних серија представљене су следећим структурама: Ц.2Кс4, Ц.3Кс6, Ц.4Кс8, Ц.5Кс10, Ц.6Кс12, Ц.7Кс14, Ц.8Кс16, Ц.9Кс18, Ц.10Кс20... Може се видети да сваки следећи угљоводоник садржи још један угљеник и још два водоника.
Постоји графичка ознака места и редоследа хемијских једињења између атома у молекулу, која показује структурну формулу алкена. Уз помоћ валентних цртица означава се веза угљеника са водоникима.
Може се приказати структурна формула алкенау проширеном облику, када су приказани сви хемијски елементи и везе. Концизнији израз за олефине не показује једињење угљеника и водоника помоћу валентних цртица.
Скелетна формула означава најједноставнију структуру. Изломљена линија представља основу молекула, у којој су атоми угљеника представљени његовим врховима и крајевима, а везе означавају водоник.
Како настају олефинска имена
На основу систематске номенклатуре, формулеалкени и њихова имена су састављени од структуре алкана повезаних са засићеним угљоводоницима. Да би се то учинило, у име потоњег, суфикс -ан се замењује са -илен или -ен. Пример је стварање бутилена из бутана и пентена из пентана.
Да бисте означили положај двоструке везе у односу на атоме угљеника, на крају имена наведите арапски број.
Назив алкена заснован је на нотацијинајдужи ланац угљоводоника у коме је присутна двострука веза. За почетак бројања ланаца обично се бира крај који је најближи незасићеном једињењу атома угљеника.
Ако структурна формула алкена имагране, затим назначе имена радикала и њихов број, а испред њих стављају бројеве који одговарају месту у ланцу угљеника. Након тога следи назив самог угљоводоника. Бројеве обично прате цртица.
Има незасићених радикалних изданака. Њихова имена могу бити тривијална или су формирана према правилима систематске номенклатуре.
На пример, ХНЦ = ЦХ- се назива етенил или винил.
Изомери
Молекуларне формуле алкена не могу указивати на изомерију. Међутим, за ову класу супстанци, са изузетком молекула етилена, својствена је просторна модификација.

Изомери етилен угљоводоника могу бити угљенични скелет, положај незасићених веза, међукласни или просторни.
Општа формула алкена одређује количинуатома угљеника и водоника у ланцу, али он не показује присуство и место двоструке везе. Пример је циклопропан као међуразредни изомер Ц.3Кс6 (пропилен). Остале врсте изомерије појављују се у Ц.4Кс8 или бутен.
Другачији положај незасићене везе примећен је убутен-1 или бутен-2, у првом случају двоструко једињење се налази у близини првог атома угљеника, ау другом - у средини ланца. Изомерија угљеничног скелета може се размотрити на примеру метилпропена (ЦХ3-Ц (ЦХ3) = ЦХ2) и изобутилен ((ЦХ3) 2Ц = ЦХ2).
Просторна модификација је својствена бутену-2 утранс и цис положај. У првом случају, бочни радикали се налазе изнад и испод главног ланца угљеника са двоструком везом; у другом изомеру, супституенти су на једној страни.
Карактеризација олефина
Општа формула алкена одређује физичко стање свих представника ове класе. Почевши од етилена и завршавајући бутиленом (од Ц.2 до Ц.4), супстанце постоје у гасовитом облику. Дакле, безбојни етен има слаткаст мирис, ниску растворљивост у води, а молекулска тежина му је мања од ваздуха.
У течном облику, угљоводоници хомологног интервала из Ц.5 до Ц.17... Почевши од алкена, који има 18 атома угљеника у главном ланцу, долази до преласка физичког стања у чврсти облик.
Сматра се да су сви олефини слабо растворљиви уводено окружење, али добро у органским растварачима, попут бензена или бензина. Њихова молекулска тежина је мања од воде. Повећање ланца угљеника доводи до повећања температурних индикатора током топљења и кључања ових једињења.
Особине олефина
Структурна формула алкена показује присуство ускелет двоструке везе π- и σ- једињења два атома угљеника. Оваква структура молекула одређује његова хемијска својства. Сматра се да π-веза није јако јака, што омогућава уништавање формирањем две нове σ-везе, које се добијају као резултат везивања пара атома. Незасићени угљоводоници су електронски донатори. Учествују у електрофилним процесима везивања.
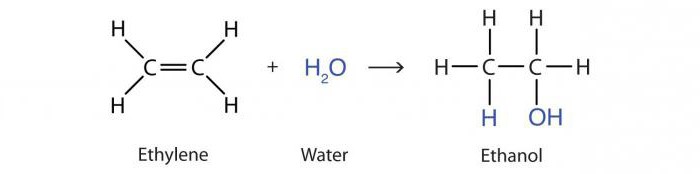
Важно хемијско својство свих алкена јепоступак халогенизације са ослобађањем једињења попут дихалогених супстанци. Атоми халогена су способни да се двоструко вежу за угљенике. Пример је бромирање пропилена у 1,2-дибромопропан:
Кс2Ц = ЦХ - ЦХ3 + Бр2 → БрЦХ2–ЦХБр - ЦХ3.
Овај поступак неутрализације боје у бромној води са алкенима сматра се квалитативним доказом присуства двоструке везе.
Важне реакције укључују хидрогенирање олифинаса додатком молекула водоника под дејством каталитичких метала као што су платина, паладијум или никл. Резултат су угљоводоници са засићеном везом. Формуле алкана, алкени су дати у наставку у реакцији хидрогенизације бутена:
Х3–ЦХ2–ЦХ = ЦХ2 + Х2 Ни→ ЦХ3–ЦХ2–ЦХ2–ЦХ3.
Позива се поступак везивања молекула водоник-халогенида за олефине
хидрохалогенизација, која се одвија према правилу,открио Марковников. Пример је хидроброминација пропилена да би се добио 2-бромопропан. У њему се водоник комбинује двоструком везом са угљеником, који се сматра најхидрогениранијим:
Х3–ЦХ = ЦХ2 + ХБр → ЦХ3–БрЦХ - ЦХ3.
Реакција додавања воде алкенима под дејством киселина назива се хидратација. Резултат је молекул алкохола пропанол-2:
Х3–ХЦ = ЦХ2 + Х2О → ЦХ3–ОХЦХ - ЦХ3.
Када су алкени изложени сумпорној киселини, долази до процеса сулфонирања:
Х3–ХЦ = ЦХ2 + ХО - ОСО - ОХ → ЦХ3–ЦХ3ЦХ - О - СО2-ОХ.
Реакција се одвија са стварањем киселих естара, на пример, изопропил-сумпорне киселине.
Алкени су подложни оксидацији током сагоревања под дејством кисеоника са стварањем воде и гаса угљен-диоксида:
2ЦХ3–ХЦ = ЦХ2 + 9О2 → 6ЦО2 + 6Х2О.
Интеракција олефинских једињења иразређени калијум перманганат у облику раствора доводи до стварања гликола или двоатомних алкохола. Ова реакција је такође оксидативна са формирањем етилен гликола и променом боје у раствору:
3Х2Ц = ЦХ2 + 4Х2О + 2КМнО4 → 3ОХЦХ - ЦХОХ + 2МнО2 + 2КОХ.
Молекули алкена могу бити укључени у процес полимеризације са слободним радикалима или катионно-анионским механизмом. У првом случају, под утицајем пероксида, добија се полимер типа полиетилена.
Према другом механизму, киселине делују као катјонски катализатори, а органометалне супстанце су анионске са ослобађањем стереоселективног полимера.
Шта су алкани
Такође се називају парафини или ограничавајућиациклични угљоводоници. Имају линеарну или разгранату структуру, која садржи само засићене једноставне везе. Сви представници хомологних серија ове класе имају општу формулу Ц.нКс2н + 2.
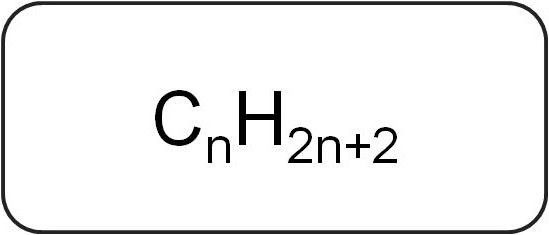
Садрже само атоме угљеника и водоника. Општа формула за алкене изведена је из нотације засићених угљоводоника.
Имена алкана и њихове карактеристике
Најједноставнији представник ове класеје метан. Следе супстанце као што су етан, пропан и бутан. Њихово име је засновано на корену бројевног броја на грчком, коме је додат суфикс -ан. Имена алкана наведена су у ИУПАЦ номенклатури.
Општа формула за алкене, алкине, алкане укључујесамо две врсте атома. Ту спадају елементи угљеник и водоник. Број атома угљеника у све три класе је једнак, разлика се примећује само у броју водоника, који се може одвојити или причврстити. Засићена једињења се добијају од засићених угљоводоника. Представници парафина у молекулу садрже 2 атома водоника више од олефина, што потврђује општа формула алкана, алкени. Структура алкена се сматра незасићеном због присуства двоструке везе.
Ако повежемо број атома водоника и угљеника у алканима, тада ће та вредност бити максимална у поређењу са осталим класама угљоводоника.
Почевши од метана и завршавајући се бутаном (од Ц.1 до Ц.4), супстанце постоје у гасовитом облику.
У течном облику, угљоводоници хомологног интервала из Ц.5 до Ц.16... Почевши од алкана, који има 17 атома угљеника у главном ланцу, физичко стање се претвара у чврсти облик.
Карактерише их изомерија у карбонском скелету и оптичке модификације молекула.
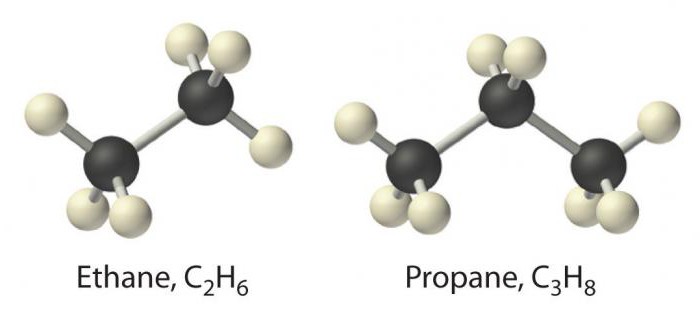
У парафину се узимају у обзир валенције угљеникау потпуности заузети суседним угљеницима или водоникима са стварањем везе σ типа. Са хемијске тачке гледишта, ово одређује њихова слаба својства, због чега се алкани називају засићени или засићени угљоводоници, лишени афинитета.
Они улазе у реакције супституције повезане са радикалном халогенизацијом, сулфохлорирањем или нитрирањем молекула.
Парафини се подвргавају оксидацији, сагоревању или разградњи на високим температурама. Под дејством акцелератора реакције долази до елиминације атома водоника или дехидрогенације алкана.
Шта су алкини
Називају се и ацетиленски угљоводоници, који имају троструку везу у ланцу угљеника. Структура алкина описана је општом формулом Ц.нКс2н - 2... То показује да, за разлику од алкана, ацетиленским угљоводоницима недостају четири атома водоника. Они су замењени троструком везом коју чине два π-једињења.
Ова структура одређује хемијска својства ове класе. Структурна формула алкена и алкина јасно показује незасићеност њихових молекула, као и присуство двоструког (Х2Ц꞊ЦХ2) и троструке (ХЦ≡ЦХ) везе.
Име алкина и њихове карактеристике
Најједноставнији представник је ацетиленили ХЦ≡ЦХ. Такође се назива етин. Долази од назива засићеног угљоводоника, у коме се уклања суфикс -ан и додаје -ин. У именима дугих алкина, број означава локацију троструке везе.
Познавајући структуру засићених угљоводоника инезасићени, могуће је утврдити под којим словом је означена општа формула алкина: а) ЦнХ2н; ц) ЦнХ2н + 2; ц) ЦнХ2н-2; д) ЦнХ2н-6. Трећа опција је тачан одговор.
Почевши од ацетилена и завршавајући бутаном (од Ц.2 до Ц.4), супстанце су гасовите природе.

У течном облику постоје угљоводоници хомологног интервала од Ц.5 до Ц.17... Почевши од алкина, који има 18 атома угљеника у главном ланцу, прелазак физичког стања се одвија у чврсти облик.
Карактерише их изомерија у карбонском скелету, у положају троструке везе, као и интеркласне модификације молекула.
У погледу хемијских карактеристика, ацетиленски угљоводоници су слични алкенима.
Ако алкини имају терминалну троструку везу, онда ониврше функцију киселине са стварањем алкинидних соли, на пример НаЦ≡ЦНа. Присуство две π-везе чини молекул натријум ацетиледина снажним нуклеофилом који улази у реакције супституције.
Ацетилен се подвргава хлорисању у присуству бакарног хлорида да би се добио дихлорацетилен, кондензација под дејством халоалкина са ослобађањем молекула диацетилена.
Алкини су укључени у реакције додавањаелектрофилна, чији је принцип основа халогенизације, хидрохалогенизације, хидратације и карбонилације. Међутим, такви процеси су слабији од процеса алкена са двоструком везом.
За ацетиленске угљоводонике су могуће нуклеофилне реакције додавања молекула алкохола, примарног амина или водоник-сулфида.








